1èrPRO - Caractériser quantitativement une solution aqueuse
Caractériser quantitativement une solution aqueuse
Ajouter à mes favoris
| Capacités | Connaissances |
| Réaliser une solution de concentration en quantité de matière donnée par dilution ou dissolution. Calculer une masse molaire moléculaire à partir des masses molaires atomiques et de la formule chimique de la molécule. Calculer la concentration en masse d’un soluté à partir de sa concentration en quantité de matière et de sa masse molaire moléculaire. | Connaître les définitions d’une solution, d’un solvant, d’un soluté. Connaître les relations entre la masse molaire, la masse d’un échantillon et la quantité de matière (n = m/M). Connaître la relation entre la concentration en quantité de matière de soluté, la quantité de matière et le volume de la solution (C = n/V). Connaître la définition de la concentration en masse d’un soluté dans une solution. |
| Déterminer une quantité de matière présente en solution par une méthode de titrage basée sur le repérage d’une équivalence, à l’aide de relations fournies. | Savoir que le point d’équivalence d’un titrage peut se repérer par un changement de couleur de la solution dû à la présence d’un indicateur coloré ou par étude de la pente d’une courbe de titrage. |
REALISER
Sous forme de 2 TP on peut réaliser une solution de concentration en quantité de matière donnée par dilution ou dissolution.
A - T.P. N°1 Comment préparer une solution aqueuse de concentration donnée par dissolution ?
I) Objectif :
L’objectif de ce T.P. est de préparer un volume V de solution aqueuse de concentration donnée C par dissolution d’une masse m d’un soluté.
II) Matériel :
- Une balance au décigramme - Une coupelle de pesée - Une fiole jaugée de 100 mL et son bouchon - Un entonnoir à solide | - Du chlorure de sodium (NaCl) - De l’eau distillée - Une spatule |
III) Données :
Pour préparer 100 mL d’une solution saline de concentration 1,25 mol.L-1 à partir de chlorure de sodium, il faut d’abord calculer la masse de sel à dissoudre.
a) Calcul de la masse molaire moléculaire (ionique) du chlorure de sodium. M(Na) = 23 g/mol M(Cl) = 35 g/mol M(NaCl) = ................ g/mol
b) Convertir : 100 mL = .............. L
c) Transformer la formule : C = n / V
n = ............................... = .................... = 0,125 mol.
d) En utilisant la frormule m on peut caluler la masse à utiliser
m (NaCl) = .................. = ............................ = 7,25 g
IV) Protocole expérimental :
- Peser la masse m à dissoudre dans la coupelle après avoir tarer cette coupelle.
- Introduire de l’eau distillée dans la fiole jaugée jusqu’au 1/3 environ.
- Introduire à l’aide de l’entonnoir la masse m dans la fiole sans oublier de rincer la coupelle et l’entonnoir avec de l’eau distillé en récupérant l’eau de rinçage dans la fiole.
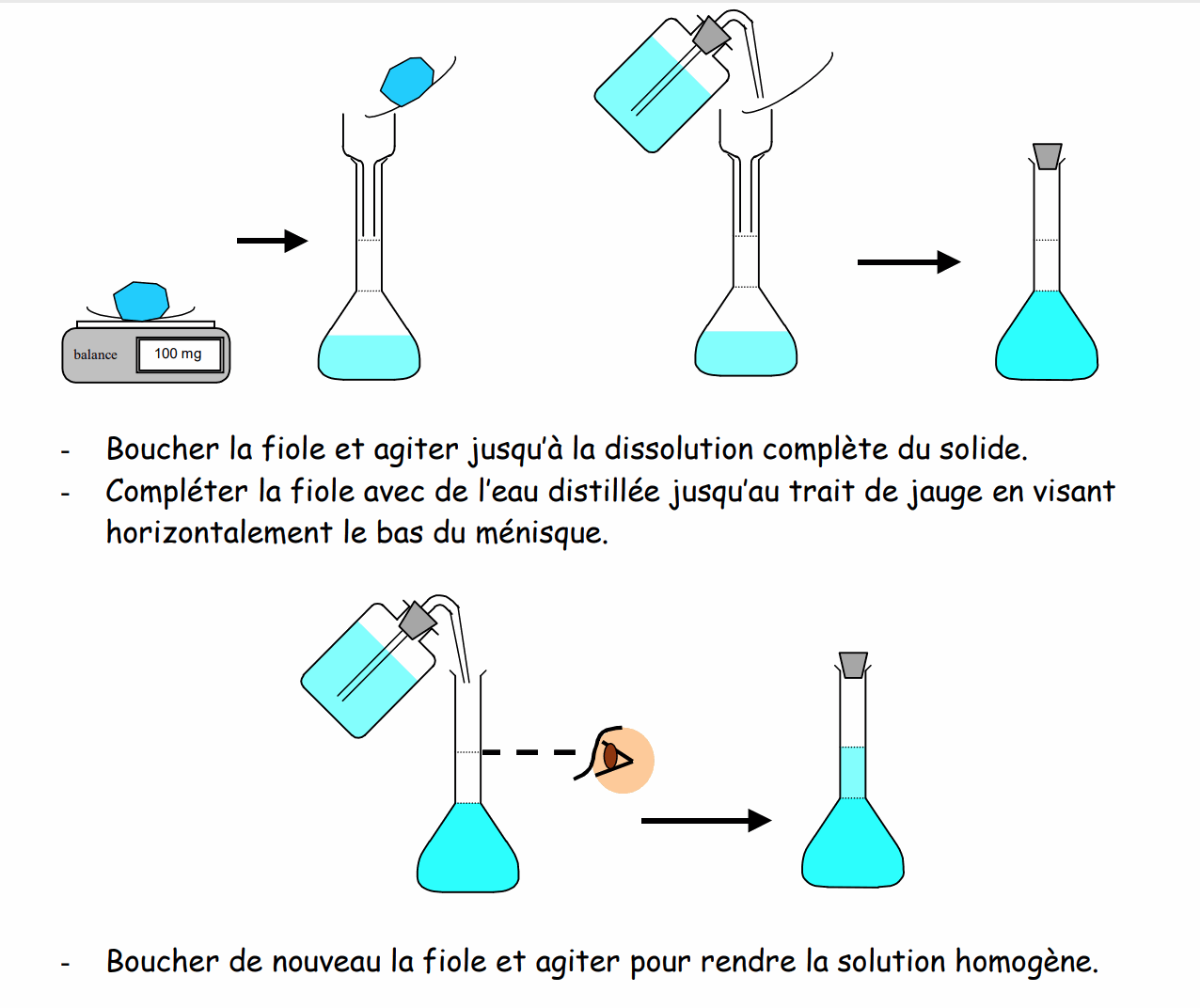
V) Observation :
Pourquoi faut-il rincer la coupelle et l’entonnoir et récupérer l’eau de rinçage ?
Pour quelle raison vise-t-on horizontalement le bas du ménisque ?
Calculer la concentration massique de la solution préparée. ( 72,5 g/L )
VI) Explication :
Une dissolution consiste à dissoudre une espèce chimique (solide, liquide ou gazeuse) appelé soluté dans un liquide (l’eau la plupart du temps) appelé solvant. Le mélange obtenu est une solution homogène
B - T.P. N°2 Comment préparer une solution aqueuse de concentration donnée par dilution ?
I) Objectif :
L’objectif de ce T.P. est de préparer un volume V2 de solution aqueuse d’une espèce chimique de concentration C2 à partir d’une solution mère de concentration C1. (C2 étant forcément inférieur à C1)
II) Matériel :
- Une fiole jaugée de 50 mL avec bouchon - Une pipette jaugée de 5 mL - Une pro-pipette ou poire à pipeter | - Solution mère de sirop de menthe de concentration C1 = 5.10-3 mol.L-1 . - De l’eau distillée |
III) Données :
Pour préparer 50 mL d’une solution de menthe de concentration C2 = 0,5.10-3 mol.L-1 à partir de la solution mère, il faut prélever ............... mL de celle-ci.
En effet : C1.V1 = C2.V2 V1 = ......................................... = ........................... = ................. mL
IV) Protocole expérimental :
- Remplir la fiole jaugée au tiers environ avec de l’eau distillée.
- Prélever V1 = 5 mL de solution mère de menthe à l’aide d’une pipette jaugée en prenant soin de repérer les traits de jauge (on vise le bas du trait du ménisque).
- Introduire ces 5 mL dans la fiole jaugée. Boucher la fiole et agiter une première fois pour rendre la solution homogène.
- Compléter avec l’eau distillée le volume V2 = 50 mL dans la fiole jaugée en visant horizontalement le bas du ménisque au niveau du trait de jauge. Boucher et agiter une dernière fois.
V) Observation :
Comparer la couleur de la solution mère et celle de la solution fille.
Quelle est la grandeur qui se conserve au cours d’une dilution : la quantité de matière, le volume ou la concentration ?
VI) Explication :
Une dilution consiste à diminuer la concentration molaire ou massique d’un soluté par l’ajout de solvant qui bien souvent est de l’eau.
B - Cours
I - La mole :
Pour pouvoir manipuler des éléments chimiques (quelques grammes), il faudrait en utiliser un très grand nombre étant donné la taille de ceux-ci (plusieurs milliards de milliards) . Une unité de quantité de matière a été créée, …………………… dont le symbole est : …………. Une mole de matière correspond donc à une quantité de matière qui peut être manipulée lors d’une expérience en chimie. Cette mole de matière correspond à un nombre d’atomes, de molécules ou d’ions avec = ……………………………………éléments.
Ce nombre que l’on a appelé ………………………………………………………………………………correspond au nombre d’atomes de carbone contenus dans ………… g de carbone, au nombre d’atomes d’hydrogène contenus dans ………… g d’hydrogène etc….
La mole - quantité de matière (regarder la vidéo)
II - Masse molaire :
On appelle masse molaire la masse en grammes d’une mole d’entité chimique. Le symbole de la masse molaire est M.
1) la masse molaire atomique :
La masse molaire atomique est la masse d'une mole d'atome de l'élément chimique considéré.
En effet, chaque atome de la classification périodique des éléments est caractérisé par deux nombres.
L'un de ces deux nombres, le nombre de masse (A), correspond à la masse d'une mole d'atomes de l'élément considéré.
Exemples : l'hydrogène H
6,02 x 10 puissance 23 atomes d'hydrogène pèsent ....... g
M(H) = ........... g/mol
Pour le carbone C on a 6,02 x 10 puissance 23 atomes de carbone pèsent ...... g. M(C) = ............ g/mo
2) La masse molaire ionique :
Un ion est un atome qui a perdu ou gagné un ou plusieurs électrons. La masse d’un atome correspond à la masse du noyau car l’électron a une masse négligeable à coté de la masse du proton ou du neutron. On peut donc dire que la masse molaire de l’ion correspond à celle de l’atome dont il est issu.
M(Cl) = ………… g/mol M(Cl- ) = ………… g/mol
M(Al) = ………… g/mol M(Al3+) = ………… g/mol.
3) la masse molaire moléculaire :
La masse molaire moléculaire est la masse ……………………………………………………………… du corps pur considéré. Elle est égale en grammes à ………………………………………………………………………………………… des éléments qui composent le corps pur.
Exemple : Le gaz carbonique CO2 est composé d’………… atome de carbone et de ………… atomes d’oxygène.
M(C) = 12 g M(O) = 16 g. donc M(CO2) = (………………) + ( ………………) = ………… + ………… = ……………… g.
Exercice : Calculer les masses molaires moléculaires des corps purs suivants (Vous utiliserez la classification périodique des éléments.)
M(CH4) = …………………………………………………………………
M(O2) = ………………………………………………………………………………………………………………………………………….
M(H2O) = ………………………………………………………………………………………………………………………………………….
M(H2SO4) = …………………………………………………
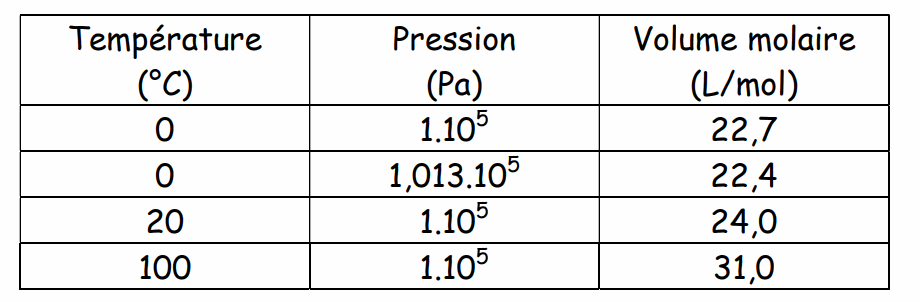
III) Le volume molaire (uniquement pour les gaz) :
Pour les gaz, on a déterminé que le volume occupé par une mole de gaz était dans les conditions normales de pression (76 cm de mercure) et de température (0° C.) 22,4 litres. Le volume molaire des gaz dépend des conditions de pression et de température.
Devoir 1 Exercice 1 : Déterminer le nombre de moles d’atomes contenues dans 167,4 g de fer Fe sachant que M(Fe) = 55,8 g/mol Exercice 2 : Déterminer le nombre d’atomes contenus dans 1 g de fer. Exercice 3 : Le réchaud à butane. Un réchaud fonctionne au gaz butane. La molécule de butane est constituée de 4 atomes de carbone et de 10 atomes d’hydrogène. a) Donner la formule brute du butane. b) Calculer la masse molaire moléculaire du butane. c) Le réchaud consomme 80 g de butane par heure de fonctionnement. Calculer le nombre de moles de butane consommées en 1 heure (arrondir à 0,1 mol). d) Calculer le volume de gaz consommé en 1 h sachant que le volume molaire est ici de 24 L / Mol. e) La bouteille contient 190 g de butane. Calculer sa durée d’utilisation dans les mêmes conditions. Donner le résultat en h. min. s. Exercice 4 : L’aspirine . L’acide acétylsalicylique ou aspirine est un analgésique (qui atténue ou supprime la sensibilité à la douleur). Un comprimé d’aspirine contient 500 mg d’aspirine de formule C9H8O4. a) Calculer la masse molaire moléculaire de l’aspirine. b) Calculer la quantité de matière contenu dans un comprimé (c’est-à-dire le nombre de moles, arrondir à 10-4). c) Calculer le nombre de molécules d’aspirine contenu dans ce comprimé. |
SUITE DU COURS
V) Concentration massique et concentration molaire :
1) Concentration massique :

Exercice : Calculer la concentration massique si on dissout 1,2 g d’acide éthanoïque (acide acétique) CH3COOH dans 200 cL de solution (attention aux unités).
2) Concentration molaire :

Exercice :
On obtient une solution aqueuse d’hydroxyde de sodium (soude) en introduisant 2,0 g de NaOH(s) dans 500 mL d’eau distillée.
a) Calculer la masse molaire de l’hydroxyde de sodium. En déduire la quantité introduite (nombre de moles) dans les 500 mL. (M(Na) = 23 g/mol ; M(O) = 16 g/mol ; M(H) = 1 g/mol)
b) Trouver la concentration molaire de cette solution.
VI) Préparation d’une solution de concentration donnée
On peut préparer une solution de concentration donnée par
- dilution :
La dilution - conservation de la masse. Au cours d’une dilution la quantité de matière (nombre de moles) d’une solution reste constante, c’est le volume de solvant qui augmente n = C1.V1 = C2.V2
- dissolution :
La dissolution - concentration massique. Après calcul de la masse m de soluté à dissoudre, on ajoute le soluté et on agite.

Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.