2ndeBP Identifier expérimentalement des ions en solution aqueuse
Ajouter à mes favoris
Identifier expérimentalement des ions en solution aqueuse
I) Dissolution d’un cristal ionique :
1) La solubilité d’un corps dans l’eau.
Lorsque le sel se dissout dans l’eau, l’eau est appelée le ……………, le sel le ………………. Lorsque l’on ajoute trop de sel dans l’eau, celui-ci ne se dissout plus, la solution est …………………. Bien souvent, la solubilité d’un corps augmente avec la ……………………………….
La solubilité d’un soluté dans l’eau est ……………………………………………………………………………………………… ………………………………………………………………. (Exemple : à 20 °C, la solubilité du chlorure de sodium est …………………… g / L).
2) Expérience :
On relie une cuve à électrolyse remplie d’eau distillée à un circuit électrique. Le circuit électrique est composé de :
D’une pile, d’un interrupteur et d’une lampe
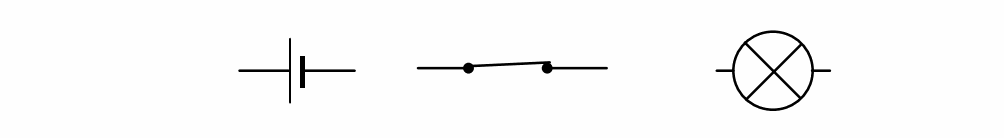
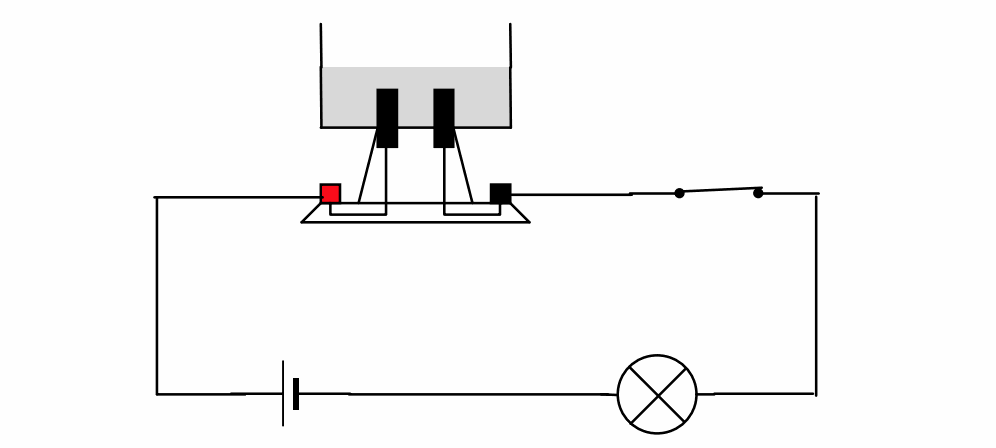
On ferme l’interrupteur, la lampe témoin ne s’allume pas, le courant électrique ne circule pas.
On y ajoute de l’eau distillée et on ferme l’interrupteur, la lampe témoin ne s’allume pas, le courant électrique ne circule pas.
On vide la cuve à électrolyse, on y ajoute cette fois en plus de l’eau distillée, du sucre. On ferme l’interrupteur, la lampe témoin ne s ‘allume toujours pas, le courant ne circule pas.
On vide à nouveau la cuve et en plus de l’eau distillée, on ajoute du chlorure de sodium, après avoir fermé l’interrupteur, on constate que la lampe témoin s’allume et que le courant circule.
Conclusion :
L’eau a rompu le cristal de chlorure de sodium NaCl en ses deux composants Na+ et Cl- .
Ces deux ions chargés électriquement circulent dans la solution et permettent ainsi le passage du courant électrique. Un cristal ionique, en solution, ………………………………………………………………………………………………………….
On écrit : NaCl --> Na+ + Cl-
3) Présence d’ions dans une solution :
Lors de la dissolution d’un cristal ionique dans l’eau, les ions se dissocient les uns des autres et s’entourent de molécules d’eau.
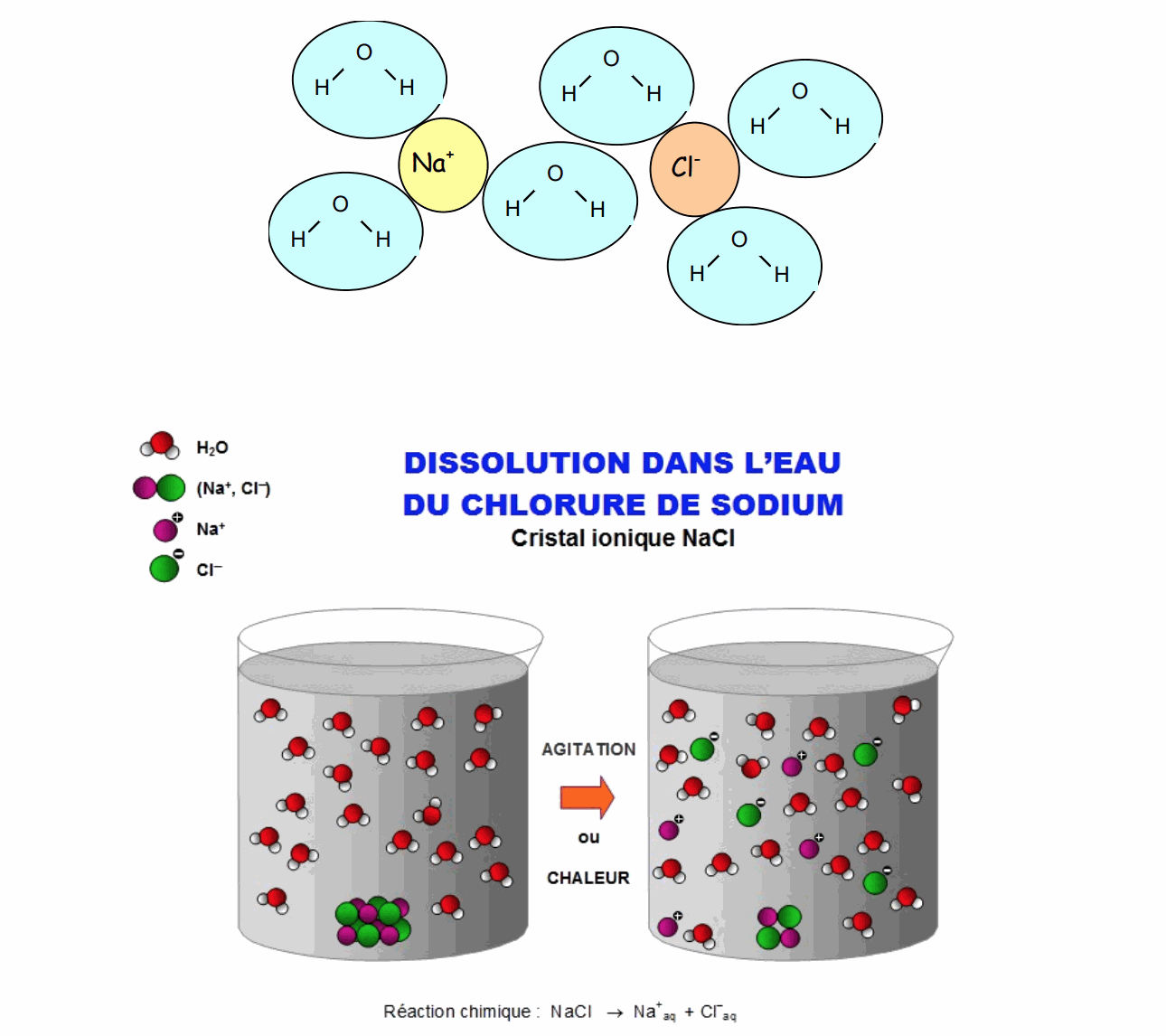
C’est ce qui explique que le chlorure de sodium n’est plus visible après sa dissolution. En augmentant la quantité de chlorure de sodium, le nombre de molécules d’eau n’est plus suffisamment important pour entourer chaque ions, la solution devient ………………………… .
Dans certains cas, la dissolution de cristaux ioniques s’accompagne d’une ………………………… qui peut renseigner sur la présence d’ions spécifiques dans la solution.
Exemples :
Une solution …………………… est un indice de la présence des ions cuivres Cu2+
Une solution …………………… est un indice de la présence des ions permanganates MnO4 - .
De nombreuses solutions contenant des ions sont cependant incolores.
4) Principe d’identification de quelques ions :
Pour déterminer la nature des ions en solution, différents tests d’identification peuvent être pratiqués. Nous utiliserons le principal qui se base sur le phénomène suivant : Lorsque l’on mélange deux solutions ioniques dont l’un des cations (ion ………………) et l’un des anions respectifs (ion ………………) ne peuvent coexister au sein d’une même solution, il se produit un précipité (sorte de petit nuage) c’est-à-dire l’apparition d’un solide. (Voir le T.P. - Identifier des ions en solution aqueuse )
Voir les 2 vidéos suivantes :
Formation d'un solide ionique - et - Tests caractéristiques en chimie
II - T.P. - Identifier des ions en solution aqueuse ?
I) Objectif :
L’objectif de ce T.P. est de déterminer quels sont les réactifs qui nous permettent d’identifier la présence de certains ions.
II) Matériel :
| 3 tubes à essais + support 1 pissette contenant de l’eau distillée 1 chiffon Solutions : - Chlorure ferrique - Chlorure ferreux - Chlorure de sodium - Sulfate cuivrique | - Acide sulfurique - Sulfate ferreux - Chlorure cuivrique Réactifs : -Nitrate d’argent - Chlorure de baryum - Soude Un récipient « poubelle » |
III) Données :
Lorsque des ions ne peuvent pas coexister (exister ensemble) en solution, il se forme un produit insoluble dans l’eau composé de particules solides qui apparaissent en formant un petit « nuage ». Ce produit est appelé précipité . Nous allons utiliser cette propriété pour mettre en évidence certains ions.
IV) Protocole expérimental :
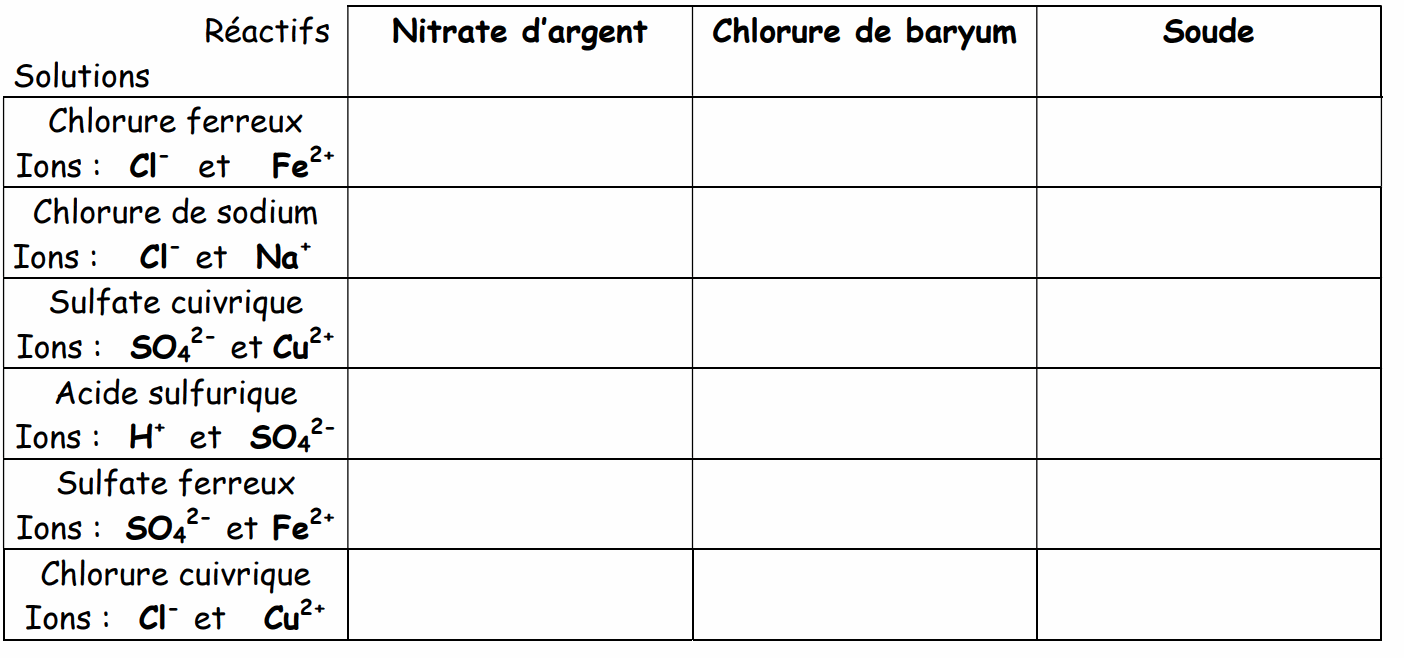
Dans 3 tubes à essais, versez une hauteur d’environ 2 cm de solution à tester. Attention, s’il y a excédent de solution, il est interdit de reverser cet excédent dans les bouteilles. Les réactifs seront disposés sur la paillasse dans l’ordre proposé par le tableau afin d’éviter de les inverser. A l’aide d’un compte-gouttes ou d’une micro-pipette ajoutez dans le premier des trois tubes 2 à 3 gouttes de nitrate d’argent, dans le deuxième quelques gouttes de chlorure de baryum et dans le troisième quelques gouttes de soude. Attention, ne pas agiter les tubes pour bien voir le précipité.
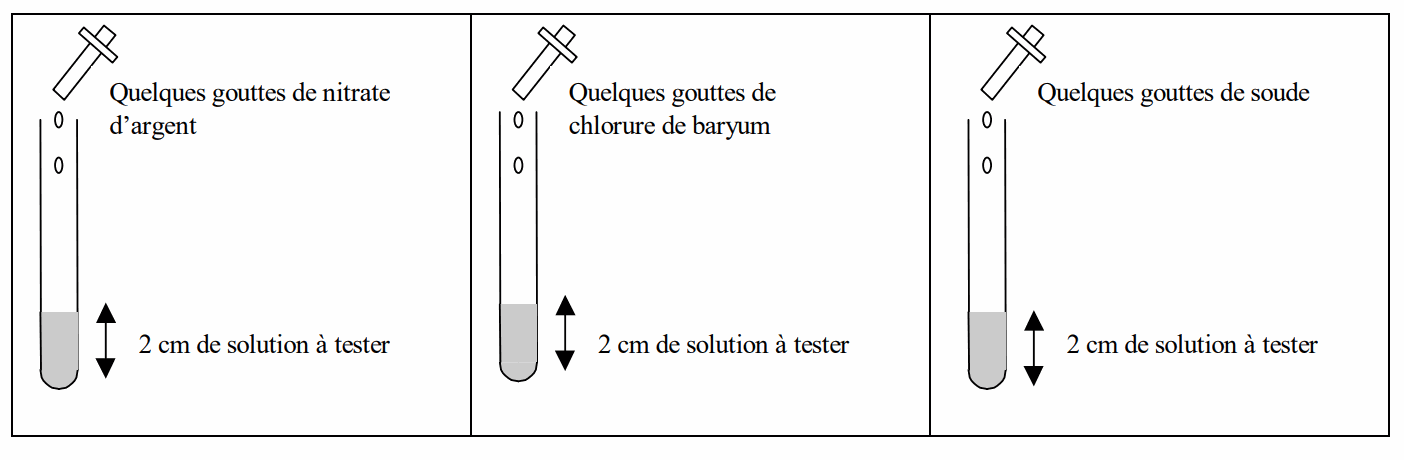
V) Observation :
Observez et notez les résultats dans le tableau suivant :
Effectuez les mêmes tests à partir des solutions indiquées dans le tableau. Complétez le tableau. Entre chaque manipulation, le contenu des tubes sera versé dans le récipient « poubelle » et ceux-ci seront lavés à l’eau du robinet, puis rincés à l’eau distillée.
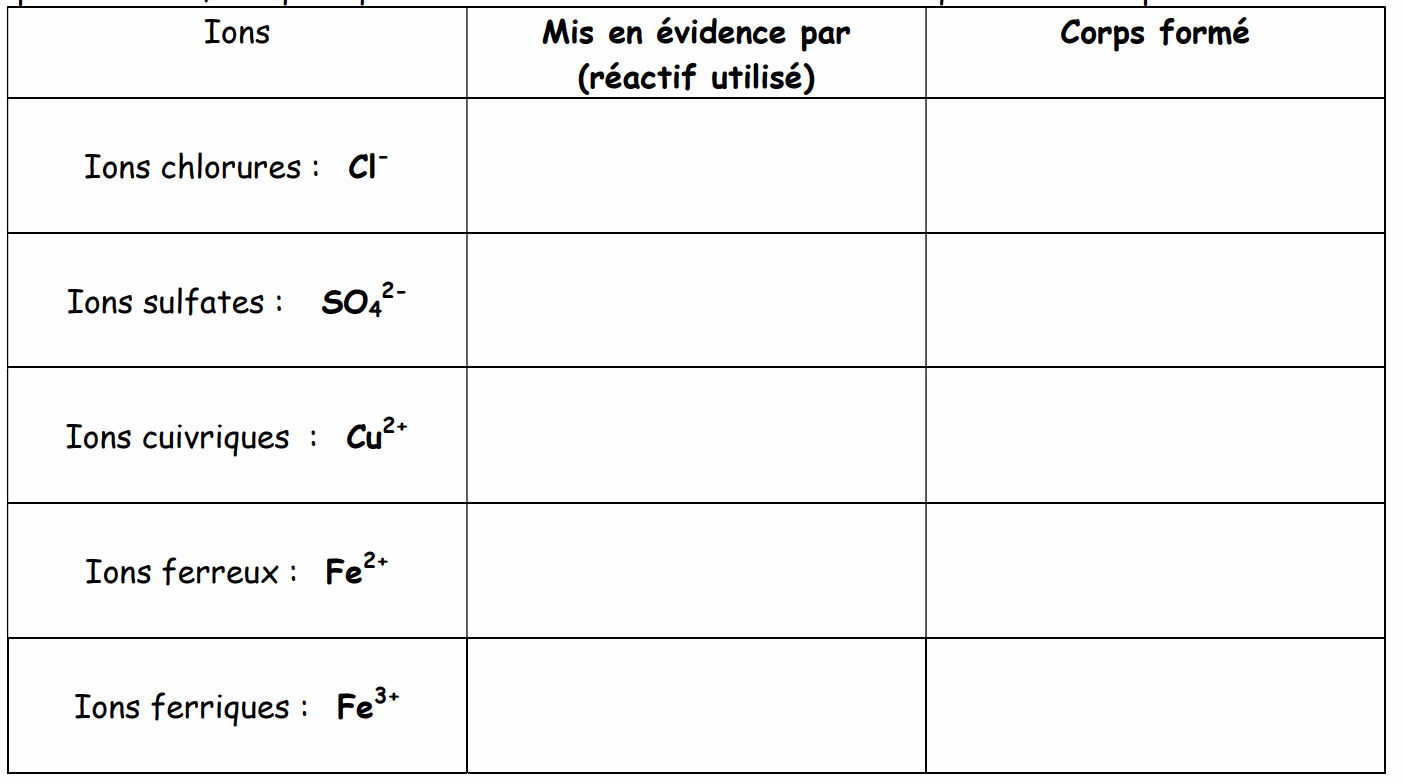
VI) Explication :
A partir des observations du tableau précédent et des différents recoupements que vous pouvez faire, indiquez quel réactif met en évidence tel ion et quel est le corps formé .

Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.