3ieme partie - CME 4-3 Comment chauffer ou se chauffer
Comment utiliser un gaz ou un liquide inflammable pour chauffer ou se chauffer
Ajouter à mes favoris
| Capacités | Connaissances | Exemples d'activités |
| Réaliser une expérience de combustion d'un hydrocarbure et identifier les produits de la combustion. Mettre en évidence que de l’énergie thermique est libérée par la combustion d’un hydrocarbure. Écrire et équilibrer l'équation d'une combustion d'un hydrocarbure. | Connaître les produits de la combustion complète ou incomplète d'un hydrocarbure dans le dioxygène. Savoir que la combustion d’un hydrocarbure libère de l’énergie. | Calcul de la masse ou du volume d'un réactif ou d'un produit dans une réaction chimique connaissant son équation. Mesure de l’ordre de grandeur de la chaleur dégagée par la réaction de combustion d’un composé organique. Recherche documentaire : danger des combustions incomplètes, effets du monoxyde de carbone sur l’organisme humain, effet de serre. Recherche documentaire sur les chaudières à gaz, à fioul, à bois. |
Le gaz naturel et le pétrole forment les ressources naturelles d’hydrocarbures.
Aujourd’hui, la plus grande partie des hydrocarbures distribués par les producteurs est brûlée dans le dioxygène de l’air pour produire de la chaleur. L’énergie thermique issue de la combustion des hydrocarbures est utilisée pour fabriquer de l’électricité, actionner les moteurs des véhicules ou chauffer les bâtiments.
I) - Identifier les produits de la combustion complète d’un hydrocarbure :
Les hydrocarbures sont des composés organiques ne contenant que les éléments ...................................... et ................................................
Rappels : Le carbone est .................................... et l’hydrogène ................................

La plupart des hydrocarbures utilisés comme combustibles appartiennent à la famille des ......................................
Les .................................. ne comportent que des liaisons covalentes .........................................
La formule brute générale des alcanes est :
La terminaison de leur nom est toujours « ane » précédé d’un préfixe
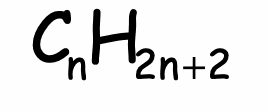
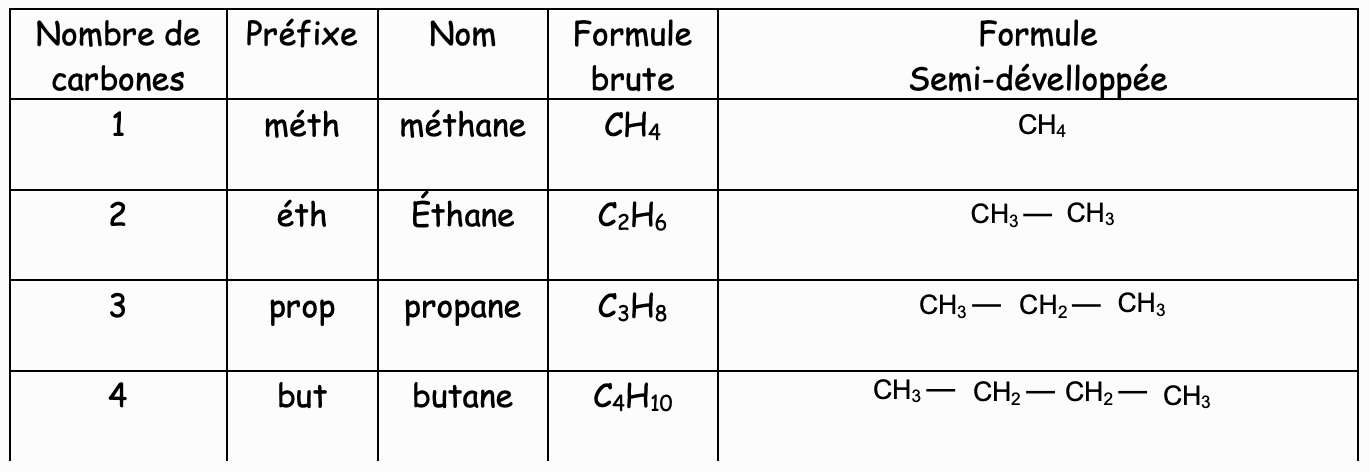
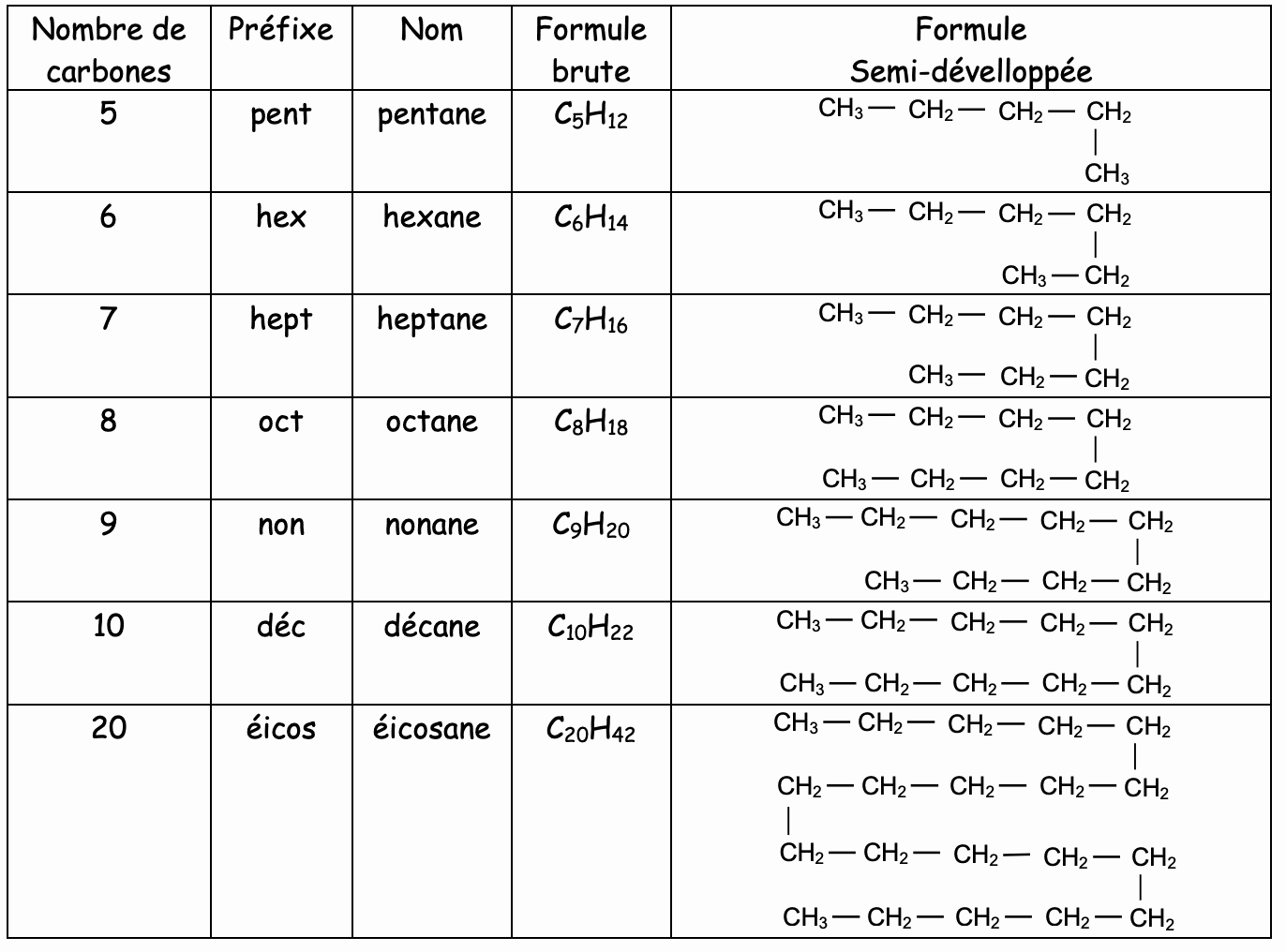
La chaîne carbonée des alcanes n’est pas toujours ................................
En effet à partir du butane, la chaîne peut se ........................................
Dans ce cas la formule brute est toujours la même, seule la structure diffère.
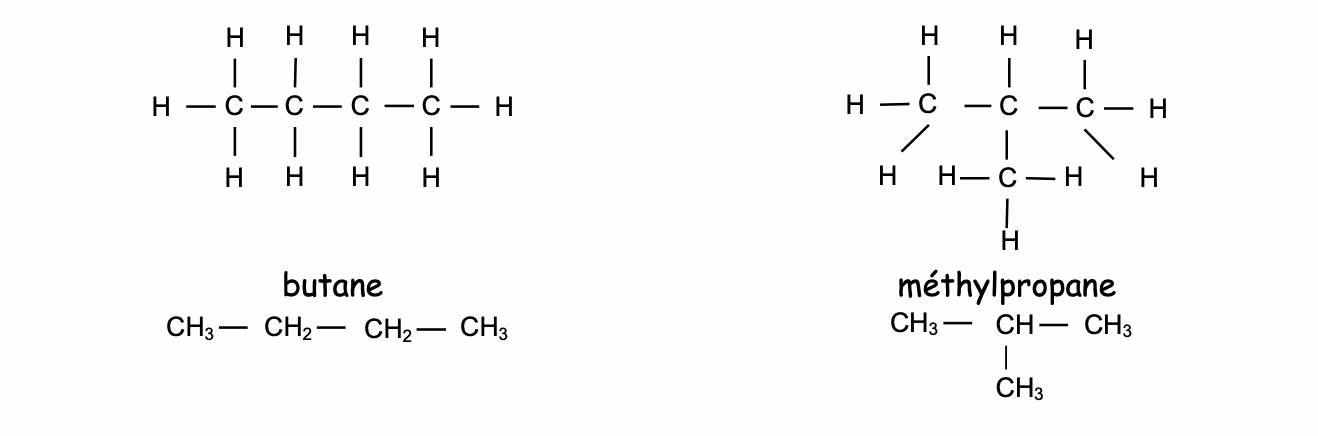
Le butane et le méthylpropane sont des ........................................
Observons le tableau suivant qui donne la constitution chimique des combustibles et des carburants usuels.
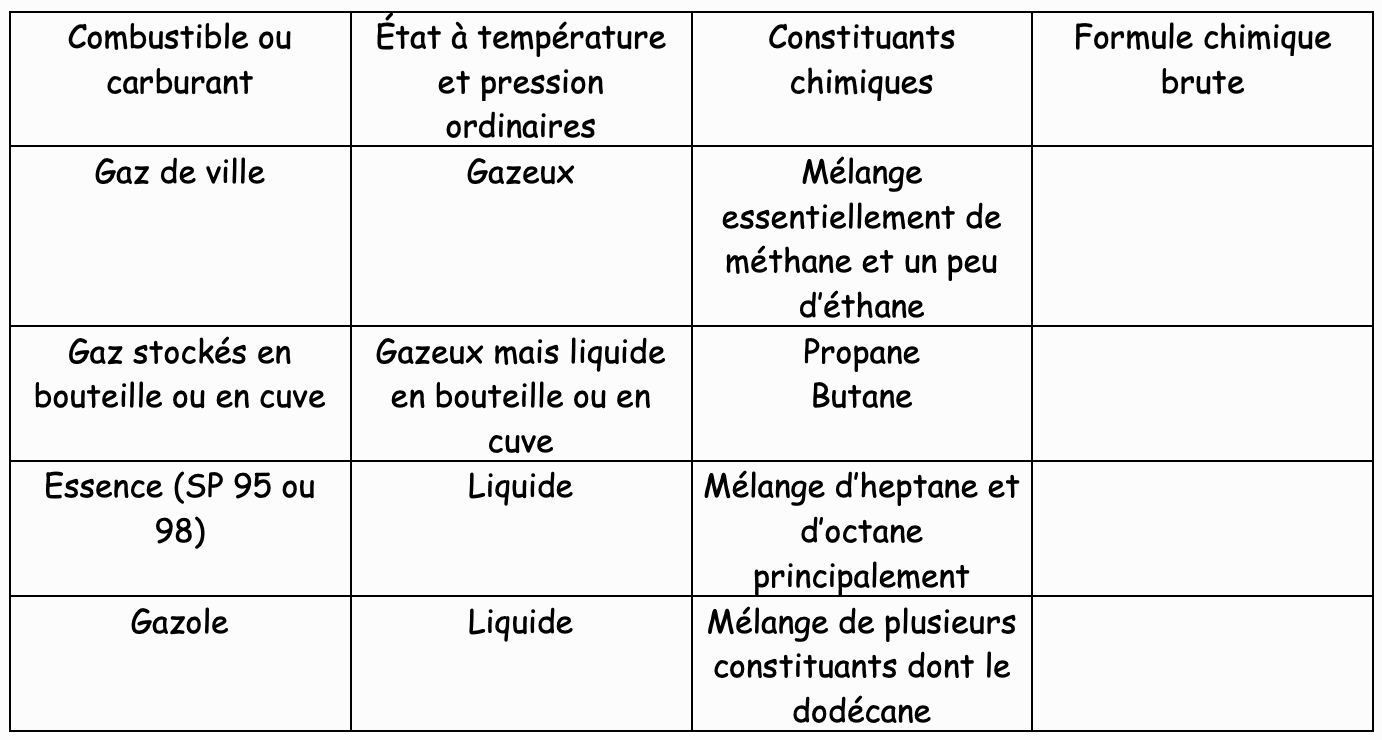
1) Que se passe-t-il lors de la combustion d’un hydrocarbure ?
La combustion est une réaction chimique au cours de laquelle les réactifs disparaissent pour laisser apparaître de nouveaux corps, les produits de la réaction.
Quels sont ces produits ?
2) la combustion d’un hydrocarbure est-elle toujours complète ?


Avec une centaine en moyenne de décès par an, le CO est la première cause de mortalité accidentelle par toxique en France. Lors de la période de chauffe 2011 – 2012 (du 1er septembre au 31 mars 2012), 3 228 personnes ont été exposées à des émanations de CO et, parmi elles, 541 ont été hospitalisées
Pourtant, certains symptômes annonciateurs d’une intoxication au monoxyde de carbone existent. Maux de têtes, nausées et vomissements sont notamment les premiers signes qui doivent alerter. Bien identifiés, ils permettent de réagir rapidement et d’éviter le pire. A l’approche du froid, de simples mesures de prévention et une bonne connaissance des symptômes peuvent aider à éviter ces accidents. C’est pourquoi, l’Institut national de prévention et d’éducation pour la santé (INPES) poursuit son action d’information sur les gestes à adopter pour prévenir une intoxication au CO et sur les réflexes à avoir en cas d’apparition des symptômes.
A disposition de tous, un dépliant rappelant les consignes d’entretien et les situations à risque est téléchargeable sur le site www.inpes.sante.frPourquoi est-ce si dangereux ?
Le CO est un gaz invisible : incolore, inodore et non irritant qui se diffuse très vite dans l’environnement. Après avoir été respiré, il se fixe sur les globules rouges à la place de l’oxygène et peut s’avérer mortel en moins d’une heure. En cas d’intoxication grave (chronique ou aiguë), les personnes gardent parfois des séquelles à vie : migraines chroniques ou bien maladies neurologiques invalidantes (troubles de la coordination motrice, paralysies de toutes formes). Ces intoxications sont suspectées de perturber le développement cérébral des enfants et notamment leur fonctionnement intellectuel.
b) Les réactions qui forment le monoxyde de carbone :
Tous les hydrocarbures brûlent dans l’air avec un dégagement de chaleur. Observons la combustion du méthane.
Dans un excès de dioxygène :
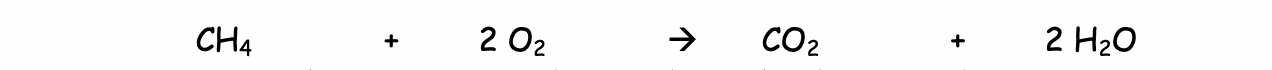
La combustion du méthane est complète. Si l'arrivée d'air (oxygène) est suffisante, le gaz est bien brûlé ; la flamme est bleue, il ne se forme alors que de la vapeur d'eau et du dioxyde de carbone.

Lorsque le dioxygène fait défaut :
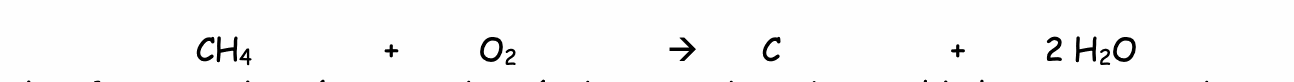
Il se forme sur les récipients des résidus noirs de carbone. S'il n'y a pas assez de dioxygène, la combustion est alors incomplète, la flamme est très orange. Le gaz est mal brûlé, il reste du carbone (noir de fumée) et il peut se former en plus du monoxyde de carbone (gaz très toxique).

Il se forme du monoxyde de carbone qui est un gaz incolore et inodore extrêmement toxique car il se combine avec le fer de l’hémoglobine du sang de manière irréversible.
Le méthane étant lui-même un gaz incolore et inodore, les producteurs de gaz lui ont ajouté un gaz odorant afin de détecter les éventuelles fuites. Dans les mines, les « coups de grisou » étaient difficile à prévenir, le grisou n’étant en fait que du méthane.
Lors d'une réaction de combustion, il est nécessaire de placer des coefficients stoechiométriques devant certains réactifs ou produits pour que le principe de conservation de la matière s'applique
On équilibre comme suit :
| - les atomes de carbone relever le nombre d'atomes de carbone dans les réactifs déterminer le nombre a positionner devant la formule contenant du carbone dans les produits |
| - les atomes d'hydrogène relever le nombre d'atomes d'hydrogène dans les réactifs déterminer le nombre a positionner devant la formule contenant de l'hydrogène dans les produits |
| calculer le nombre d'atomes d'oxygène dans les produits déterminer le nombre à positionner devant la formule du dioxygène des réactifs afin d'obtenir le même nombre |
II) - Combustion d’un hydrocarbure : quels aspects énergétiques ?
La combustion est donc une réaction chimique au cours de laquelle les réactifs disparaissent pour laisser apparaître de nouveaux corps, les produits de la réaction. Certaines réactions chimiques sont ............................................................, c’est à dire qu’elle produisent de la chaleur. (Dans une réaction chimique .............................................................., l'énergie dégagée par la formation de liaisons dans les produits est supérieure à l'énergie requise pour briser les liaisons dans les réactifs. Le contraire d’une réaction ....................................................................... est une réaction ...................................................................., la température baisse au cours d’une telle réaction.)
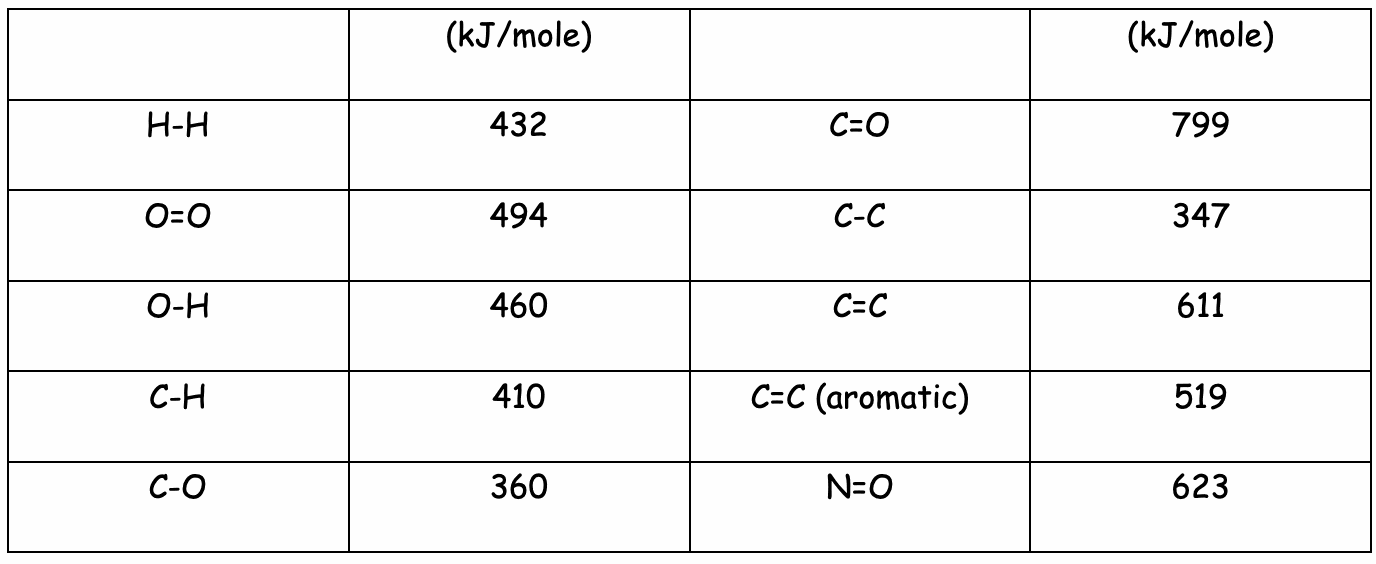
Il est possible de calculer la quantité d’énergie fournie lors d’un réaction chimique exothermique. Le tableau suivant indique la quantité d’énergie correspondant à la destruction ou à la fabrication de certaines liaisons.




Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.