CME5-3 Pourquoi adoucir l'eau
Ajouter à mes favoris
3. Pourquoi adoucir l’eau ?
| Capacités | Connaissances | Exemples d'activités |
| Mettre en évidence expérimentalement la présence d’ions Ca2+ et Mg2+ dans une solution aqueuse. Déterminer expérimentalement le degré hydrotimétrique d’une eau. | Connaître le mécanisme de formation d'un ion positif ou négatif. Savoir que les ions Ca2+ et Mg2+ sont responsables de la dureté d'une eau. | Recherche documentaire sur le rôle d'une résine échangeuse d'ions. |
I) La formation des ions : rappels
La matière est constituée de particules appelées .......................
L’atome est constitué de deux parties :
- Un ................................................... contenant des ................................................ (électriquement neutres) et des ......................................... (électriquement positifs).
- Un nuage ou cortège ....................................(électriquement négatifs) gravitant autour du noyau.
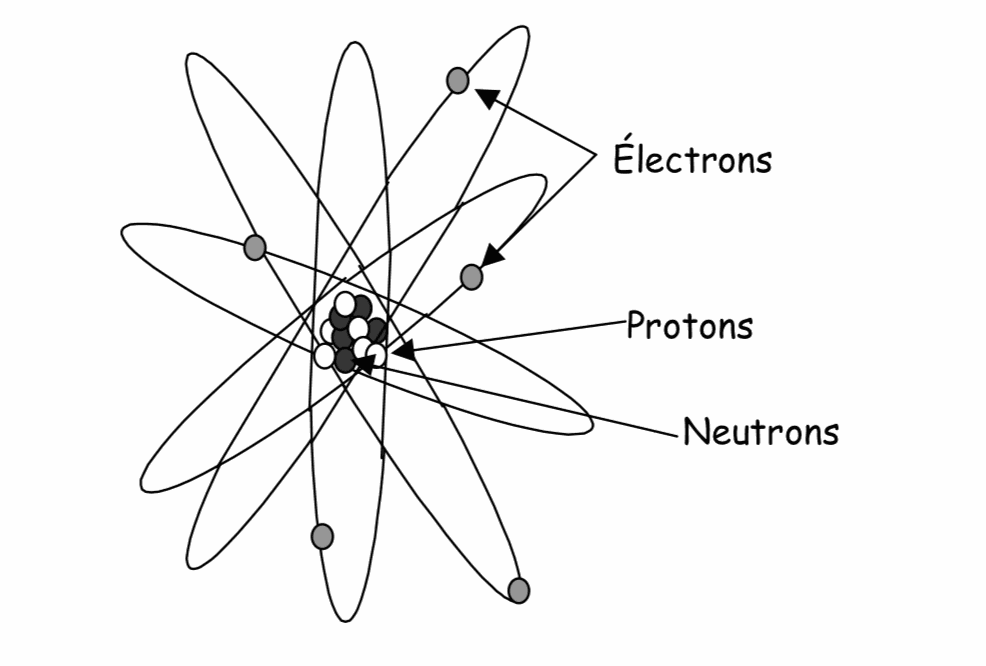
Dans certaines réactions chimiques, pour acquérir une stabilité maximale, les atomes peuvent gagner ou perdre un ou plusieurs ............................. Ils deviennent alors des ...........................
Un atome qui gagne un ou plusieurs électrons devient à son tour porteur d’une ou plusieurs charges : Il devient un ion .................. ou ............................
Un atome qui perd un ou plusieurs électrons acquiert une charge ..................., il devient un ion ..........................ou ......................
Exercice : Compléter les phrases suivantes :
a) Un atome de sodium Na perd un électron, il devient alors un .......................... de formule ..................
b) Un atome de fluor F gagne un électron, il se transforme en .......................... de formule .......................
c) L’ion magnésium Mg2+ est un atome de ................................... qui a ........................................... électrons.
d) L’ion sulfure S2- est un atome de .................................. qui a. .......................................... électrons.
II) La dureté des eaux et ses conséquences :
L’eau est un solvant qui contient des gaz (dioxygène, diazote, dioxyde de carbone) et des solides dissous ( sous forme d’ions).
Parmi les ions en solution, l’ion calcium ............., et l’ion magnésium .................. dans une moindre mesure, posent problèmes. Les ions calcium empêchent le savon de mousser, ils peuvent également former du tartre .................. qui est insoluble et qui se fixe sur les parois et dans les tuyauteries lorsque la température de l’eau est supérieur à 70 °C.
La dureté est le caractère d’une eau contenant des ions calcium ou magnésium. Elle se mesure en France par le degré français ( ................).
1 °F correspond à une concentration globale de ...................... mol/L d’ions Ca2+ ou Mg2+ .
La dureté est également appelée ................................, exprimé en ............................
Classification de l’eau en fonction de la dureté :
- Eau très douce
- Eau douce
- Eau demi-dure
- Eau dure
- Eau très dure
Pour les eaux potables, il est souhaitable d’avoir TH ≤ .....................°F, l’idéal étant de .....................°F.
Les conséquences d'une eau dure sur les appareils ménagers En ce qui concerne la dureté de l’eau et les tâches ménagères, une eau dure présente deux problèmes. Le premier est la formation de dépôts de carbonate de calcium (tartre) qui endommagent les machines et diminuent l’efficacité des systèmes de production d’eau chaude, ce qui engendre une dépense d’énergie accrue. Le second problème concerne les savons et détergents. En effet, dans des eaux dures chargées en ions positifs, ces produits sont moins efficaces et doivent donc être mis en plus grandes quantités pour un résultat équivalent. Leur utilisation est donc plus coûteuse et entraîne une pollution des eaux plus importante.

Il est possible d’adoucir une eau à l’aide d’un adoucisseur ou par osmose inverse (passage au travers d’une membrane). Les adoucisseurs fonctionnent sur le principe des échanges d’ions, en remplaçant les ions calcium et magnésium par des ions sodium Na+ . Lorsque la réserve de sodium est épuisée, il faut la renouveler avec des sels d’adoucissement. A l’inverse, une eau très douce (T.H. < 10°F) entraîne des phénomènes de corrosion des canalisations favorisant la présence dans l’eau de métaux lourds (plomb, cuivre, fer, zinc…) nuisibles à la santé.
III) Les résines échangeuses d'ions
Ce sont de minuscules billes de plastique, d'un diamètre d'environ 0,6 mm. Ces billes sont poreuses et contiennent de l'eau, invisible et inamovible. On mesure la teneur en eau et on l'exprime en “rétention d'humidité”. La structure de la résine est un polymère (comme tous les plastiques) sur lequel un ion fixe a été fixé de façon permanente. Cet ion ne peut pas être enlevé ou remplacé : il fait partie de la structure. Pour préserver la neutralité électrique de la résine, chacun de ces ions fixes doit être neutralisé par un contre-ion de charge opposée. Ce contre-ion est mobile et peut sortir de la résine ou y entrer. La figure suivante représente schématiquement des billes échangeuses de cations et d'anions. Les lignes grises représentent le squelette polymère de la résine : il est poreux et contient de l'eau. Les ions fixes de la bille échangeuse de cations sont des sulfonates (SO3 – ) attachés au squelette. Dans cette image, les ions mobiles sont des cations sodium (Na+ ). Les résines échangeuses de cations, comme l'Amberjet 1 000, sont souvent livrées sous forme sodium.
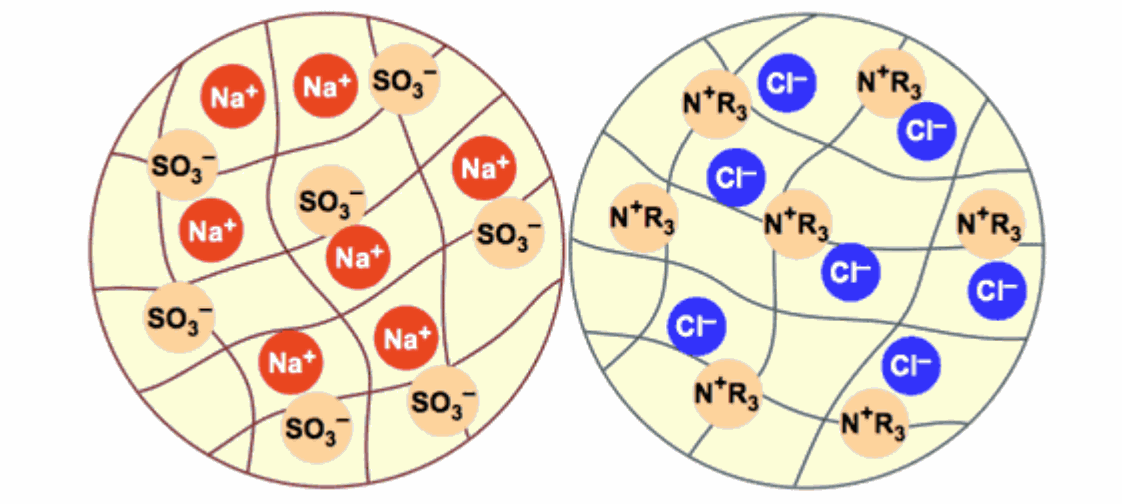
Pour adoucir l'eau, vous prenez une résine échangeuse de cations dans laquelle les ions mobiles à l'intérieur de la résine sont du sodium (Na+ ) et vous faites passer l'eau à travers une colonne remplie de cette résine sous forme sodium. Les ions Ca2+ et Mg2+ constituant la dureté passent de l'eau dans la résine, et chacun de ces ions divalents est remplacé dans l'eau par deux ions sodium qui quittent la résine.
La réaction d'échange peut s'écrire :
2 RNa + Ca2+ R2Ca + 2 Na+
La figure suivante illustre cette réaction : les billes de résine sont initialement chargées avec des ions sodium (Na+ ).Comme on le voit schématiquement, chaque ion calcium ou magnésium qui pénètre dans la résine est remplacé par deux ions sodium qui en sortent. Les anions présents dans l'eau ( qui ne sont pas représentés ici ) ne peuvent pas entrer dans la résine, car ils seraient repoussés par les anions sulfonate fixes (SO3 — ) de la résine
Cet échange de cations ne peut avoir lieu de façon efficace que parce que la résine échangeuse de cations a une affinité plus grande pour les cations formant la dureté que pour le sodium. En termes simples la résine préfère le calcium et le magnésium au sodium. Le résultat de l'opération d'adoucissement n'est pas une élimination nette des ions “durs” de l'eau, mais simplement leur remplacement par des ions sodium. Il est évident que cet échange n'est pas illimité : après un certain temps, la résine a enlevé tant d'ions calcium et magnésium de l'eau qu'il n'y a plus de place pour en accueillir d'autres. La phase dite d'épuisement (ou de saturation) est alors terminée, et il faut remplacer la résine par une charge neuve, ou la régénérer. Une fois les résines saturées, on peut les remettre sous leur forme initiale et renouveler l'opération d'échange. L'échange d'ions est donc un procédé cyclique, et non continu. La régénération des résines se fait selon des réactions inverses de celles montrées précédemment. Régénération d'un adoucisseur : La résine d'adoucissement est régénérée avec des ions sodium (Na+ ) fournis par une solution de chlorure de sodium (NaCl, ou sel commun). La réaction de régénération est : R2Ca + 2 NaCl 2 RNa + CaCl2 La régénération ne peut se faire que quand la concentration du régénérant est élevée, typiquement 1 000 fois plus haute que la concentration dans de l'eau normale. Par exemple, le sel est utilisé dans une saumure à une concentration de 10 % (environ 100 g/L) pour régénérer un adoucisseur. Vous avez maintenant compris pourquoi vous mettiez du sel dans votre lave-vaisselle : le sel dilué dans de l'eau régénère la résine contenue dans la cartouche d'adoucissement, habituellement invisible et située dans le bas de le machine.
Les plastiques

Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.