HS5 - 2 -Quels sont les principaux constituants d'un lait
Les différentes familles chimiques
Ajouter à mes favoris
Objectif : Reconnaître et nommer les molécules constituant le lait.
Problématique :
Quelles sont les formes des molécules qui composent le lait et quelles en sont les quantités ?
La composition d’un bol de lait est représentée ci-contre.

I. Rappels de base de la chimie organique.
La chimie organique est une branche de la chimie concernant l’étude de molécules contenant du carbone et de l’hydrogène.
Toutes les molécules composant la vie et nécessaires à celle-ci sont étudiées par la chimie organique.
Une molécule organique se forme à la base d’une chaîne d’atomes de carbones reliés entre eux, les atomes d’hydrogène venant compléter la molécule en respectant la valence de chaque atome (4 liaisons autour d’un atome de carbone, une seule sur un atome d’hydrogène).
On représente alors une molécule en faisant apparaître la chaîne d’atomes de carbone avec leurs atomes d’hydrogène. (Ex : CH3-CH2-CH3 : le propane). D’autres groupements viennent s’ajouter.
II. Les groupes fonctionnels en chimie organique
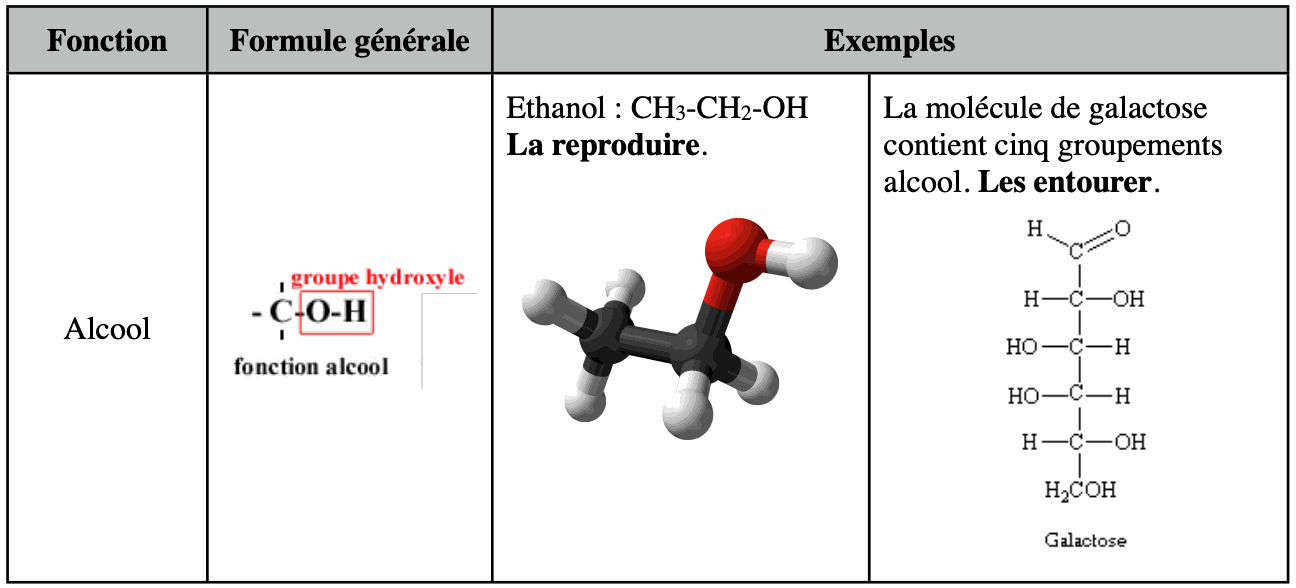
1. Fonction alcool, groupe Hydroxyle.
Dans le lait, le glucide le plus abondant est le lactose. La molécule de lactose est composée d’une molécule de galactose et d’une molécule de glucose reliées entre elles. Ces molécules renferment le groupement alcool et le groupement aldéhyde.
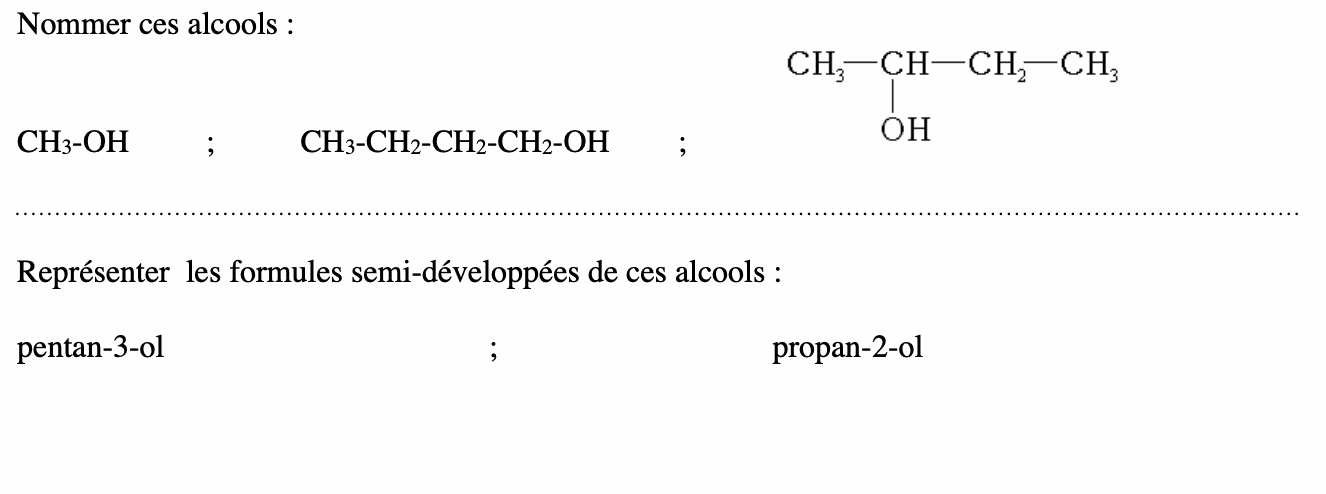
2. Fonction aldéhyde, groupe carbonyle.
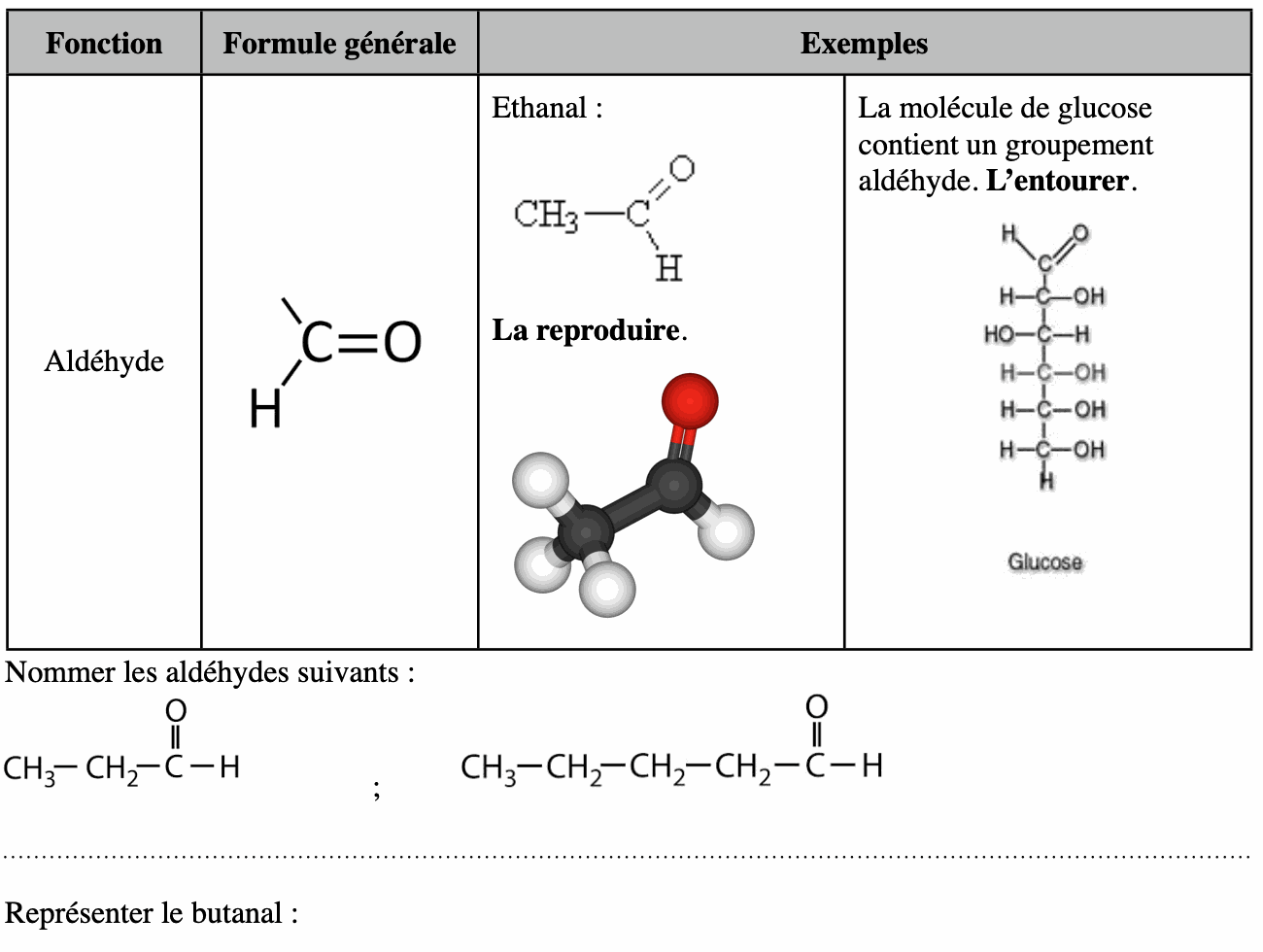
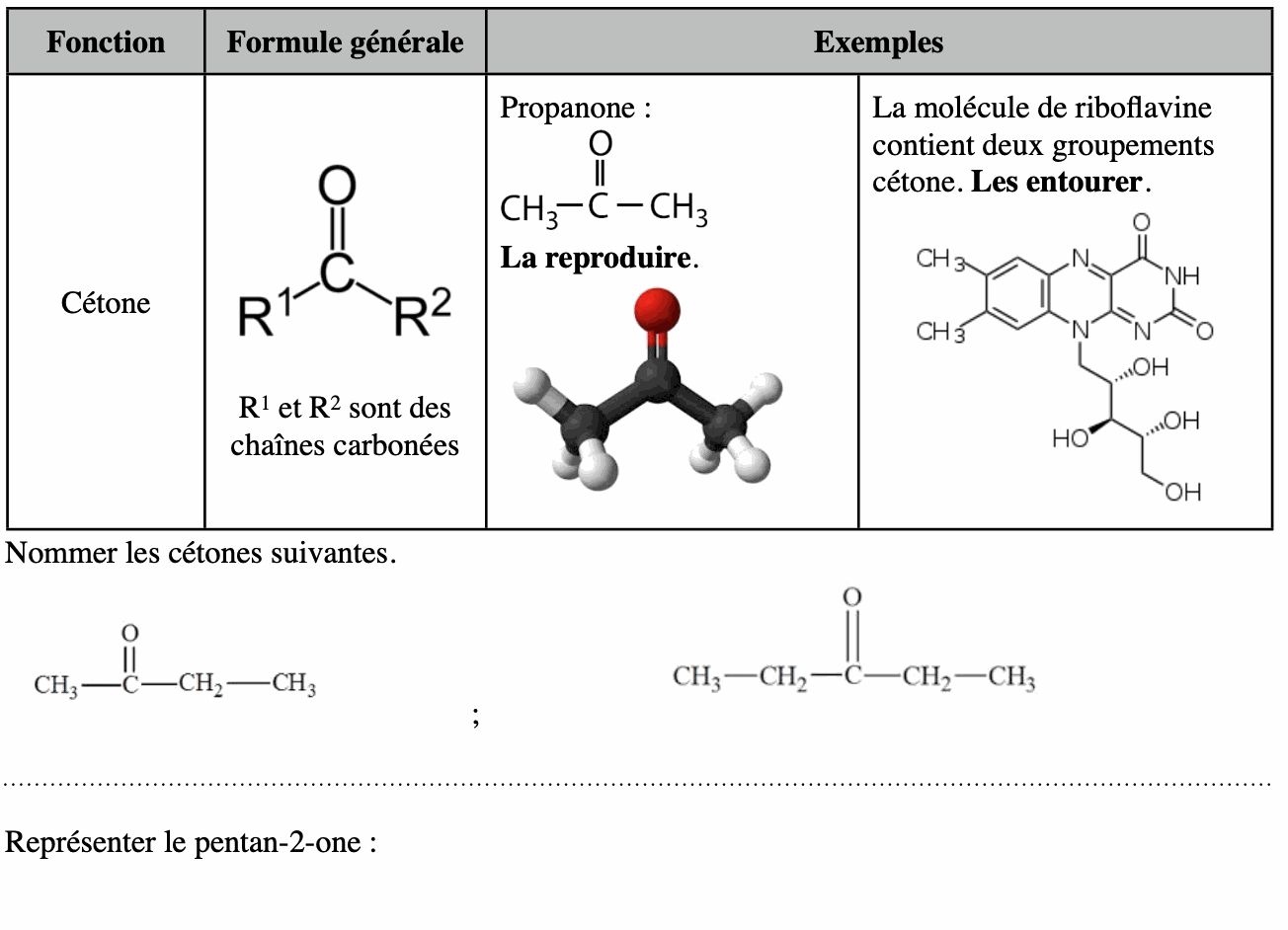
3. Fonction cétone, groupe carbonyle.
Le lait contient de la riboflavine (vitamine B2), dont la molécule renferme le groupement cétone.
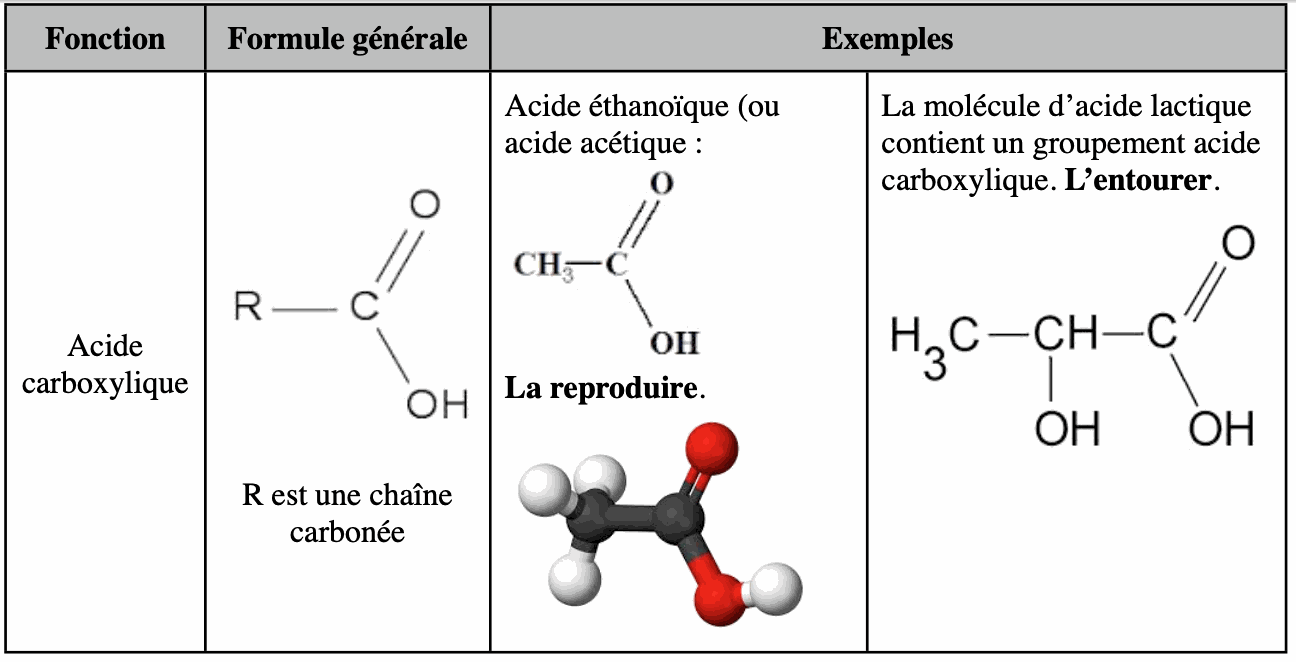
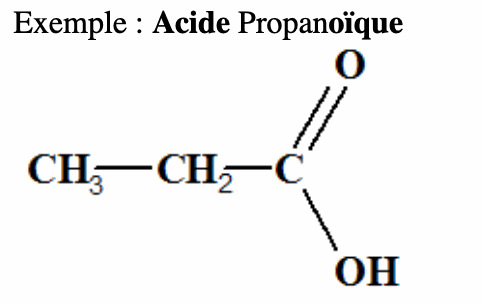
4. Fonction acide carboxylique, groupe carboxyle.
La présence d’acide lactique dans le lait provient de la fermentation du lactose. Sa molécule contient le groupement acide carboxylique.
III. Retour à la problématique
1. Les protéines
80% sont des protéines de caséine, 20% sont des séroprotéines.
Calculer les masses de protéines de caséine et de séroprotéines dans le bol. ............................................................................................................................................................................................................................................................................................................................................................
2. Les lipides
95% sont des triglycérides de formule brute C55H98O6.
Calculer la masse de triglycéride dans le bol. ...................................................................................................................................................................
Calculer la masse molaire moléculaire de la triglycéride. ..................................................................................................................................................................
Calculer la quantité de matière (en mol) de cette substance dans le bol. ..................................................................................................................................................................
3. Les glucides (le lactose)
De formule brute C12H22O11, le lactose est le principal glucide du lait.
Calculer la masse molaire moléculaire du lactose. ..................................................................................................................................................................
Calculer la quantité de matière, en mol, de lactose dans le bol. ......................................................................................................................................................................................................................................................................................................................................
Données : M(H) = 1g/mol ; M(C) = 12 g/mol ; M(O) = 16 g/mol
Méthode de Nomenclature
1. Nommer un alcane
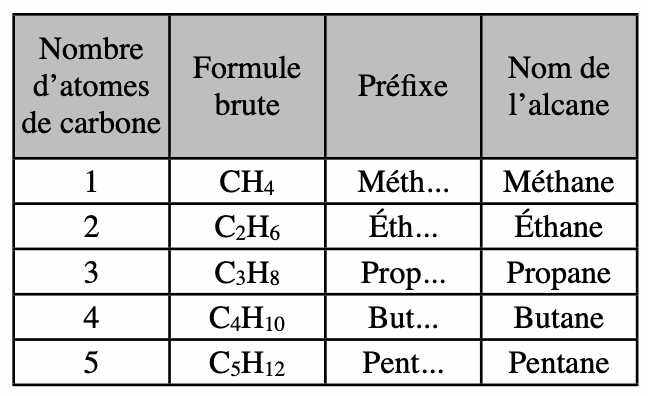
Les molécules organiques sont construites à partir de chaînes carbonées ne comportant que des atomes de carbone et d’hydrogène liés par des liaisons simples.
Ces chaînes carbonées constituent la famille des alcanes. Le nom d’un alcane dépend du nombre d’atomes de carbone, il se termine toujours par «ane»
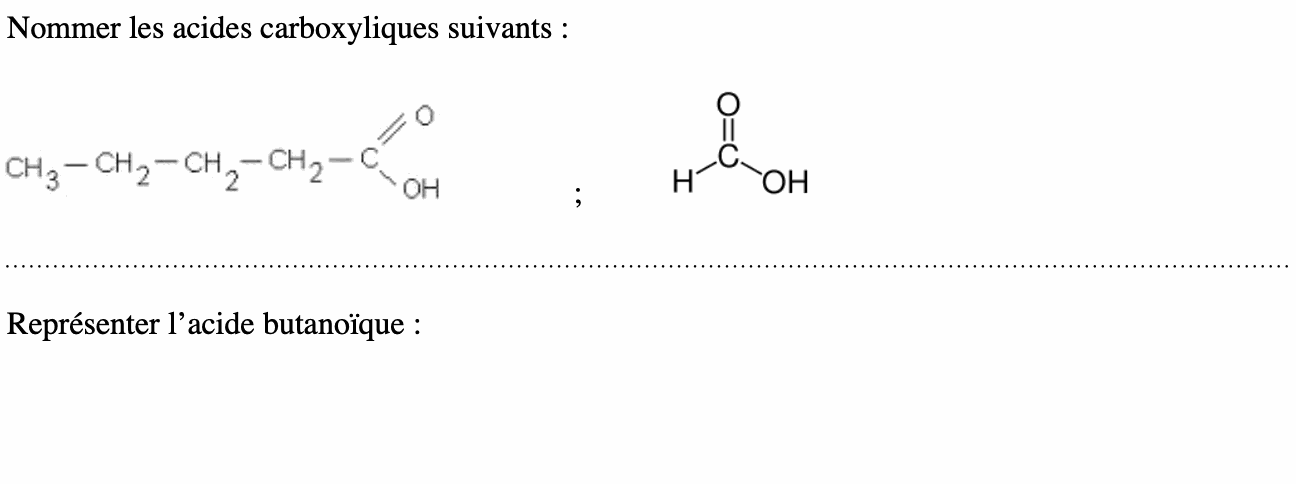
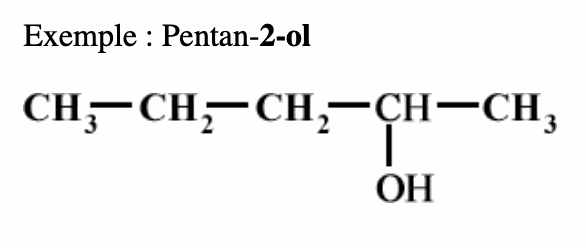
• Repérer et nommer la chaîne carbonée la plus longue contenant le groupe -OH.
• Numéroter la chaîne en commençant par l’extrémité la plus proche du groupe -OH.
• La terminaison «e» de l’alcane est remplacée par la terminaison «-ol» et précédée de la position du groupe -OH.
• Repérer et nommer la chaîne carbonée la plus longue contenant le groupe -COH.
• La terminaison «e» de l’alcane est remplacée par la terminaison «al» (il n’est pas nécessaire de préciser la position du groupe -COH).
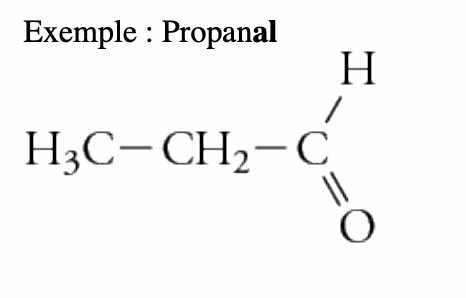
La démarche est la même que celle utilisée pour l’alcool sauf que la terminaison du composé est «-one»
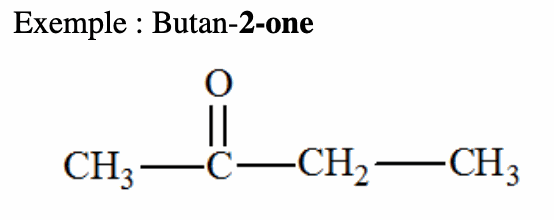
La démarche st la même que celle utilisée pour l’aldéhyde, sauf que le nom du composé est précédé du mot «acide» et la terminaison est «oïque».
Exercices
Exercice 1 :
On ajoute quelques gouttes de filtrat (petit-lait) dans un tube à essai contenant de la 2,4-DNPH. Un précipité jaune-orangé se forme. Quels composés a-t-on identifié ?
...................................................................................................................................................................................................................................................
Dans un autre tube à essai contenant un peu de filtrat, on verse quelques gouttes de liqueur de Fehling et on chauffe. Un précipité rouge brique se forme. Quels composés le lait contient-il ?
...................................................................................................................................................................................................................................................
Exercice 2 :
Associer chaque molécule numérotée à son nom :
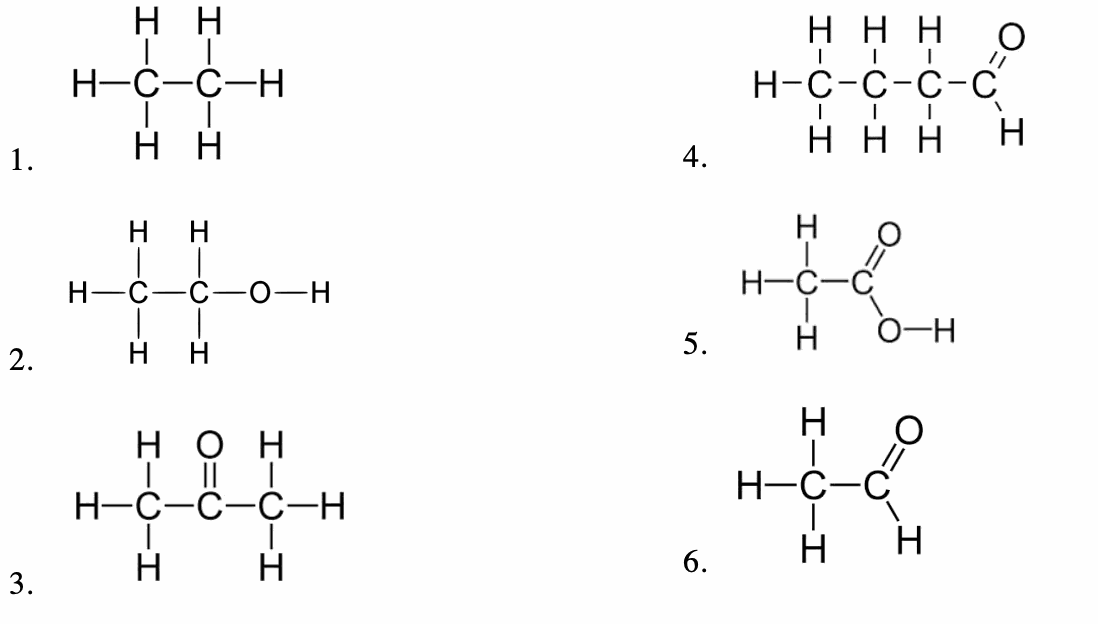
Noms : éthanol, éthane, acide éthanoïque, éthanal, propanone.
Exercice 3 :
Ecrire les formules semi-développées des composés suivants :
Butanone : acide propanoïque :
propan-2-ol : pentanal :
Exercice 4 : Analyse de laits
Le tableau ci-dessous donne la composition, pour 100g, de trois laits de consommation.
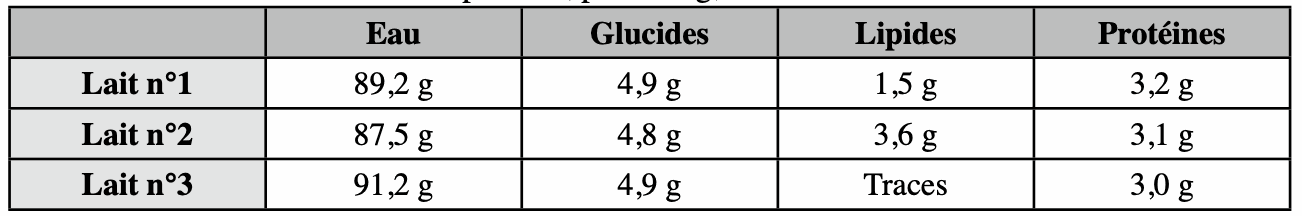
1. Parmi ces trois laits se trouvent : un lait entier, un lait demi-écrémé et un lait écrémé. Attribuer à chacun d’eux sa dénomination. Justifier.
..................................................................................................................................................................................................................................................
2. Quel est le glucide le plus abondant dans le lait ?
..................................................................................................................................................................................................................................................
3. Quels composés sont toujours présents en même quantité (environ) dans tous les laits ?
..................................................................................................................................................................................................................................................
Exercice 5 : Fabrication du fromage
Dans la fabrication de certains fromages, le lactose du lait de formule C12H22O11 est transformé en acide lactique par fermentation.
La formule semi-développée de l’acide lactique est :
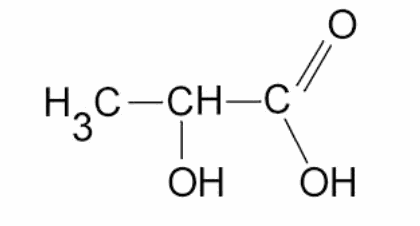
1. Entourer et nommer les deux groupes fonctionnels présents dans cette molécule.
L’équation non équilibrée de la transformation du lactose en acide lactique est la suivante :
C12H22O11 + H2O → ...... CH3 ⎯ CHOH ⎯ COOH
2. Equilibrer cette équation.
3. Calculer la masse molaire moléculaire du lactose.
...............................................................................................................................................................................................................................
4. Un litre de lait contient 50g de lactose. Calculer le nombre de moles de lactose contenues dans un litre de lait.
...............................................................................................................................................................................................................................
5. Calculer la masse d’acide lactique obtenue si 1% de ce lactose se décompose selon la transformation citée di-dessus. (On donne la masse molaire de l’acide lactique : 90 g/mol).
................................................................................................................................................................................................................................
.................................................................................................................................................................................................................................
.................................................................................................................................................................................................................................
Evaluations
HS5 - Devoir

Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.