La mole
Ajouter à mes favoris
Notions et compétences attendues
Déterminer la masse molaire d’une espèce à partir des masses molaires atomiques des éléments.
Déterminer la quantité de matière d’un corps pur à partir de sa masse et du tableau périodique.
Utiliser le volume molaire d’un gaz pour déterminer une quantité de matière.
Déterminer la quantité de matière de chaque espèce dans un mélange (liquide ou solide) à partir de sa composition.
Déterminer la quantité de matière d’un soluté à partir de sa concentration et du volume de solution.
Expliquer ou prévoir la couleur d’une espèce en solution à partir de son spectre.
Déterminer la concentration d’un soluté à partir des mesures d’absorbance de solutions de concentrations connues.
Proposer et mettre en œuvre un protocole pour déterminer la concentration d’une espèce colorée en solution par des mesures d’absorbance.
Notions
La masse molaire - M
La masse molaire atomique M d’un élément est la masse d’une mole d’atomes de cet élément. Elle s’exprime en g·mol–1.
La masse molaire moléculaire M est la masse d’une mole de molécules. Elle est égale à la somme des masses molaires atomiques de tous les atomes qui composent la molécule.
La masse des électrons étant négligeable devant celle de l’atome, la masse molaire d’un ion monoatomique est considérée comme égale à la masse molaire atomique de l’élément correspondant.
La quantité de matière - n
La quantité de matière n est la grandeur utilisée pour dénombrer des entités (atomes, molécules, ions, etc.). Elle s’exprime en mol.
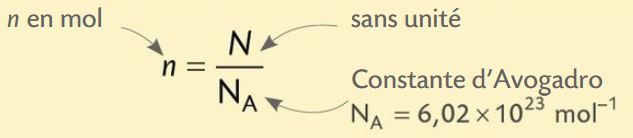
La quantité de matière n d’une espèce chimique de masse m et de masse molaire M est :
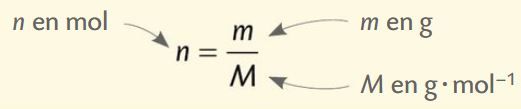
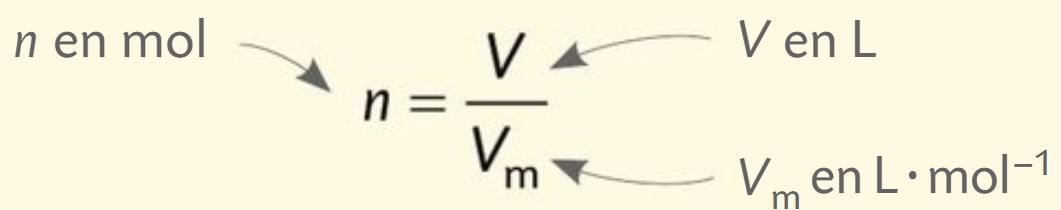
Pour un gaz, à 20 °C et 1013 hPa, le volume occupé par une mole de ce gaz est Vm = 24,0 L·mol–1. À température et pression fixées, tous les gaz ont le même volume molaire.
La concentration en quantité de matière
La concentration en quantité de matière d’une espèce chimique en solution est le quotient de la quantité de matière n de soluté par le volume Vsolution de la solution :
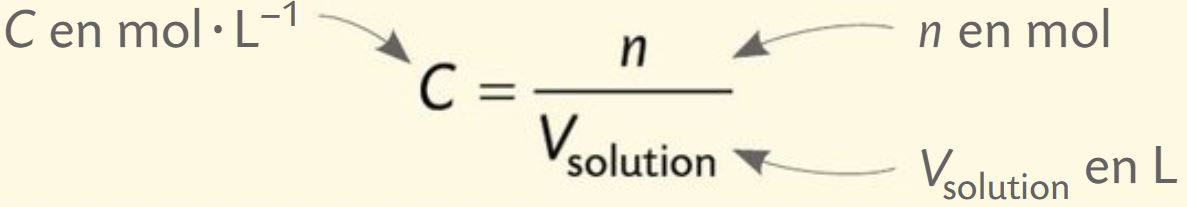
La relation entre la concentration en quantité de matière C et la concentration en masse t d’une espèce chimique, de masse molaire M, dans une solution est :
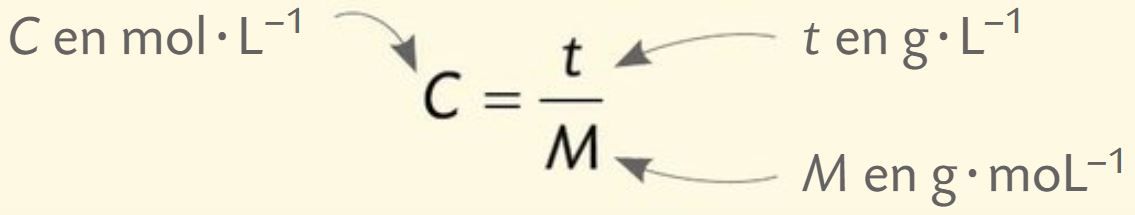
Activités
Calculer une quantité de matière
Une bille de plomb de diamètre un millimètre contient N = 1,7 x 10^19 atomes de plomb. Exprimer puis calculer la quantité de matière n de plomb contenue dans la bille.
Calculer un nombre de molécules
Une goutte d’eau contient une quantité de matière n = 2,1 x 10^-3 mol d’eau. Exprimer puis calculer le nombre de molécules d’eau contenues dans la goutte.
Calculer une masse molaire
Calculer la masse molaire moléculaire de l’éphédrine, de formule C10H15NO, à l’aide des extraits du tableau périodique ci-dessous.
Déterminer une masse molaire moléculaire puis une masse
On prélève une quantité de matière n = 2,9 x 10^-2 mol de vanilline, de formule chimique C8H8O3. Calculer la masse molaire moléculaire M de la vanilline. En déduire la masse m de vanilline prélevée.
Calculer un volume de liquide à partir d’une quantité de matière
La réalisation d’une solution hydroalcoolique nécessite de prélever une quantité de matière n = 2,0 x 10^-1 mol de propan-2-ol. Exprimer puis calculer la masse m de propan-2-ol. Exprimer puis calculer le volume V de propan-2-ol à prélever.
Calculer une quantité de matière
La mer Mort a une concentration en quantité de matière d'ions sodium C = 1,2 mol.L-1. Calculer la quantité de matière n d'ions sodium présente dans 200 mL d'eau de la Mer Morte.
Calculer une concentration en quantité de matière
Une solution est obtenue en dissolvant une quantité de matière n = 0,17 mol de glucose dans de l'eau. Le volume de la solution est V = 100 mL.
Exprimer la concentration en quantité de matière de glucose dans cette solution.
Calculer sa valeur en mol.L-1.
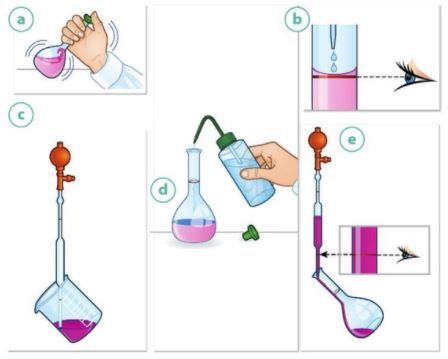
Les préparations de solution
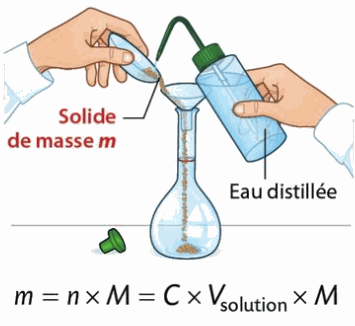
La dissolution
Pour préparer une solution de volume Vsolution à la concentration C en espèce chimique, il faut prélever puis dissoudre une masse m :
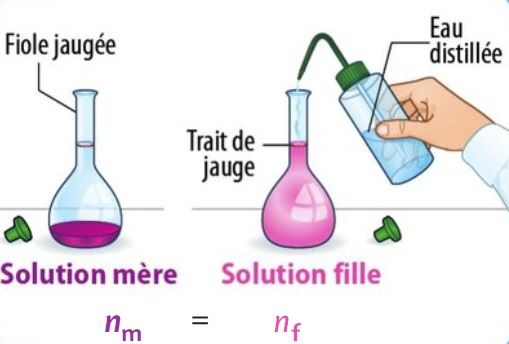
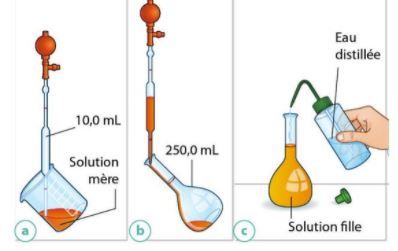
La dilution
Au cours d’une dilution, la quantité de matière de soluté prélevée dans la solution mère est égale à la quantité de matière de soluté présente dans la solution fille :
Activités
Réaliser une dilution
Les étapes de la dilution d’une solution sont données, ci-après, dans le désordre. Remettre ces étapes dans l’ordre chronologique.
Elaborer un protocole de dilution
On prépare 100,0 mL d’une solution de concentration en ions cuivre (II) Cf = 4 x 10^-4 mol.L-1 à partir d’une solution de concentration en ions cuivre (II) Cm = 1,6 x 10^-3 mol.L-1.
Élaborer le protocole expérimental de cette dilution en choississant, dans la liste ci-dessous, le matériel adapté.
Pipettes jaugées : 10,0 ; 20,0 ; 25,0 mL
Fioles jaugées : 50,0 ; 100,0 ; 150,0 mL
Calculer la concentration d'une solution fille
Une solution aqueuse a été préparée en diluant une solution de concentration en diiode selon les étapes schématisées ci-contre.
Calculer le facteur de dilution F.
En déduire la concentration C’ en diiode de la solution diluée
Absorbance et loi de Beer-Lambert
Loi de Beer-Lambert
L’absorbance A d’une solution est une grandeur sans unité liée à la proportion de lumière absorbée par la solution pour une longueur d’onde donnée.
Pour une longueur d’onde fixée, l’absorbance A d’une solution diluée de concentration C en espèce chimique colorée est donnée par la loi de Beer-Lambert, où l est l'épaisseur de solution traversée et ε est le coefficient d'absorption molaire.
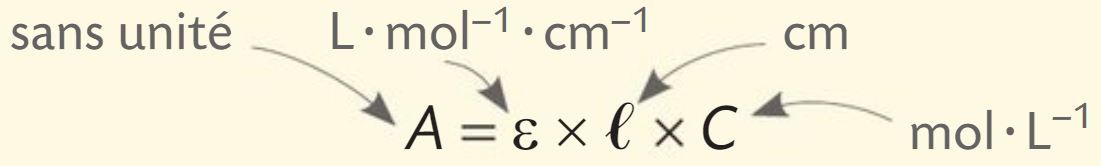
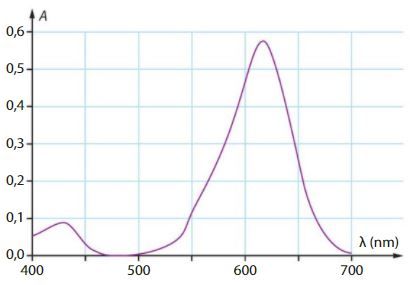
La spectroscopie
Le spectrophotomètre permet de tracer le spectre d’absorption, c’est-à-dire le graphe de l’absorbance de la solution en fonction de la longueur d’onde.
Le spectre d’absorption de la solution présente un maximum d’absorption à 640 nm (domaine orange-rouge)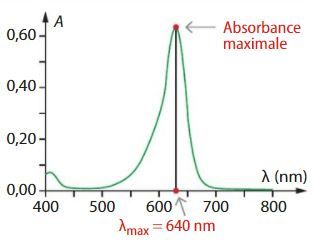
La couleur de la solution est la couleur complémentaire, opposée dans le cercle chromatique : domaine bleu-cyan.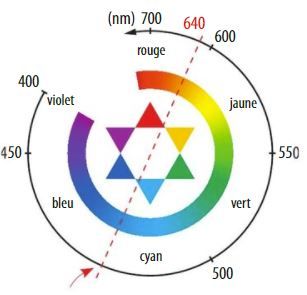
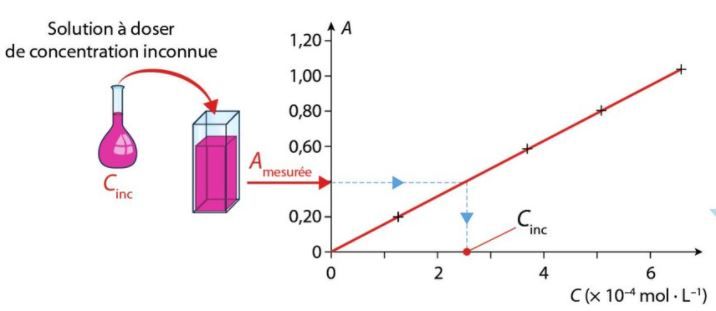
Dosage par étalonnage
Un dosage par étalonnage consiste à déterminer la concentration en espèce chimique dans une solution en comparant une grandeur physique caractéristique de cette solution (par exemple l’absorbance) à celles de solutions étalons.
Activité
Masse molaire des éléments
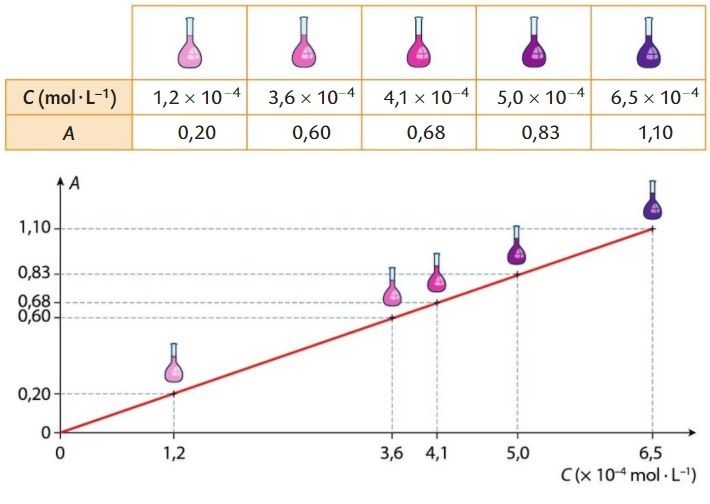
Exploiter une courbe d’étalonnage
Une courbe d’étalonnage donne l’évolution de l’absorbance en fonction de la concentration en espèce colorée d’une solution :
Énoncer la loi de Beer-Lambert.
Déterminer l’équation de la droite.
En déduire la concentration Cinc en espèce colorée correspondant à la valeur d’absorbance A = 1,12 .
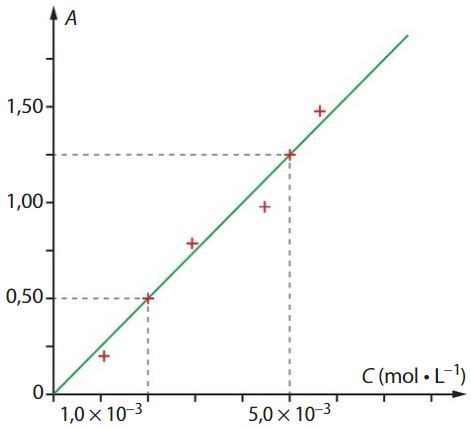
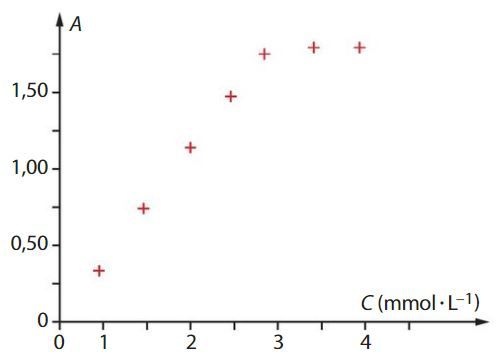
Étudier une limite d’un dosage spectrophotométrique
La courbe ci-dessous représente l’absorbance A d’une solution en fonction de sa concentration C en diiode.
Choisir, en justifiant, la longueur d’onde adaptée pour tracer la courbe d’étalonnage parmi :
490 nm ;
620 nm ;
750 nm ;
Pour quel domaine de concentrations cette courbe est-elle en accord avec la loi de Beer-Lambert ? Justifier.

Lien entre spectre d’absorption et couleur
Une solution de vert de malachite est bleue.
À quelle longueur d’onde devrait-on se placer pour doser cette solution par spectrophotométrie ? Justifier.
À partir des données, justifier la couleur de la solution.
On réalise une gamme de solutions étalons de concen-trations en vert de malachite comprises entre On réalise une gamme de solutions étalons de concentrations en vert de malachite comprises entre 0,10 mol.L-1 et 0,5 mol.L-1. Les mesures réalisées n’ont pas permis d’obtenir une droite. Proposer une explication
Déterminer la concentration en ions cuivre (II) d’une solution
On souhaite déterminer la concentration C en ions cuivre (II) Cu2+d’une solution S. Pour cela, on prépare 200 mL d’une solution S’ de concentration C = 1,0 x 10^-1 mol.L-1 en ion cuivre (II) Cu2+ par dissolution de sulfate de cuivre pentahydraté CuSO4, 5 H2O (s). Puis, on réalise plusieurs solutions étalons par dilution et on mesure leur absorbance.La mesure de l’absorbance de la solution S donne : A = 0,16.
Calculer la masse molaire du sulfate de cuivre pentahydraté.
Déterminer la masse m de sulfate de cuivre pentahydraté à prélever pour préparer la solution S’. On admet que la quantité de sulfate de cuivre pentahydraté à peser est égale à la quantité d'ions cuivre (II) dans la solution S’.
Déterminer la concentration C en ions cuivre (II) Cu2+de la solution S.


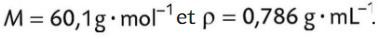
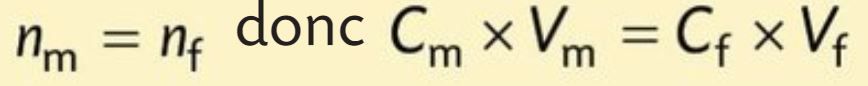
%20Cu2+de%20la%20solution%20%C3%A9talon%20(mol%C2%B7L%E2%80%931).JPG)
Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.