La saponification
Mode d'action d'un savon
Ajouter à mes favoris
I. Formule générale d'un savon.
Les savons sont des mélanges d’ions carboxylate et de cations métalliques (ions sodium ........... ou potassium .............).
L’ion carboxylate a pour formule R-COO -
Le groupe alkyle R- est une chaîne linéaire qui comporte entre 12 et 18 atomes de carbone.
On distingue deux types de savons :
- le savon dur ou carboxylate de sodium de formule ...................................................
- le savon mou ou carboxylate de potassium de formule ..................................................
II. Solubilité des savons.
L'action détergente d'un savon est liée à sa solubilité dans l'eau, c'est à dire à son pouvoir moussant.
Considérons l'oléate de sodium (C 17 H 33 -COONa) principal constituant du "savon de Marseille".
1. Solubilité dans l’eau pure.
Lors de la dissolution du savon dans l’eau, le groupe carboxylate et les ions sodium s'entourent de molécules d’eau et sont dispersés dans la solution : c'est le phénomène de solvatation.
On obtient des ions hydratés.
L'équation-bilan de la réaction de dissolution d’un savon de sodium dans l’eau est :
R-COONa (s) <----.> .............................. + ..................
La double flèche signifie que la réaction de dissolution est ...........................
2. Solubilité dans l’eau salée.
a) Expérience.
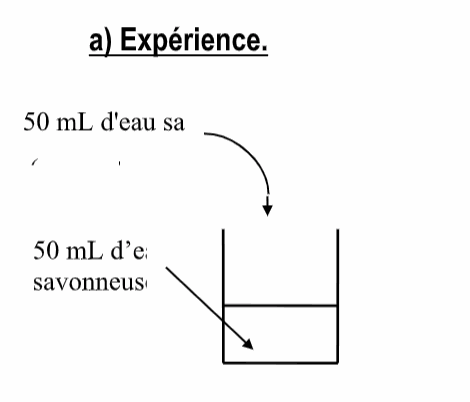
Observation
50 mL d'eau salée (.............+ ..........)
50 mL d’eau savonneuse
b) Interprétation.
Quand on ajoute des ions Na + à une solution d'eau savonneuse, on déplace l'équilibre de la réaction de dissolution dans le sens ..............
Une partie du savon dissous ................................. Cette opération s'appelle un relargage.
L'équation-bilan de cette réaction s'écrit :
..........................................................................................................
Un savon perd ses propriétés détergentes en eau ............................. (riche en ions .............. ).
3. Solubilité dans les eaux dures.
Les eaux dures sont des eaux riches en ions calcium ........... et magnésium .............
a) Expérience.
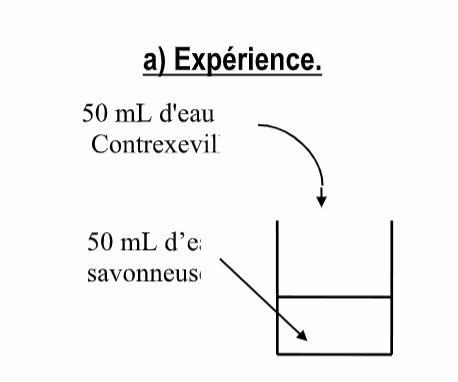
Observation
b) Interprétation.
Les ions carboxylate réagissent avec les ions magnésium et les ions calcium pour former des ............................ insolubles (savons de magnésium et de calcium).
Les équations-bilans de ces réactions s'écrivent :
..........................................................................................................
..........................................................................................................
Un savon perd ses propriétés détergentes en eau .......................... (riche en ions ...............et .................)
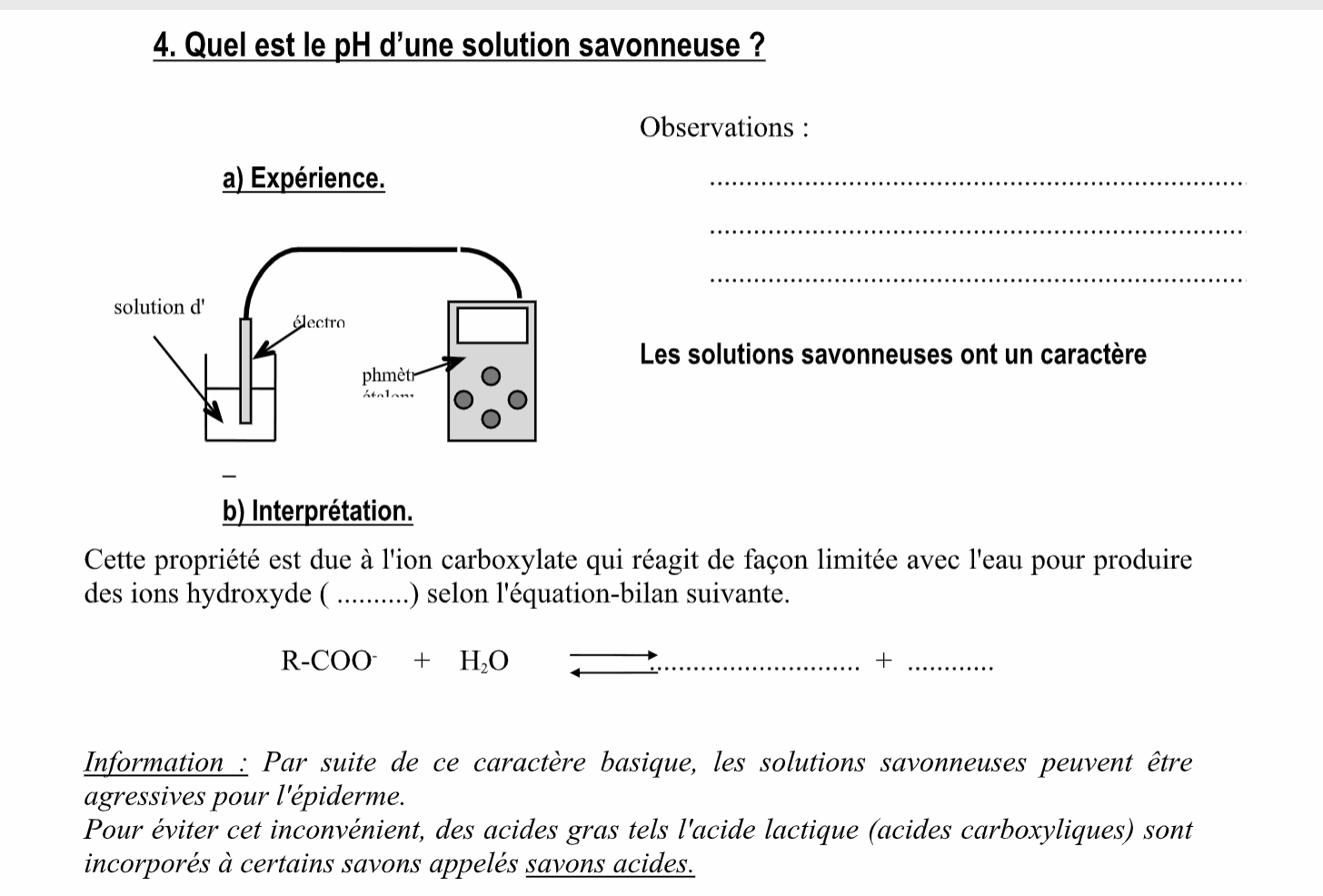
III. Mode d'action des savons.
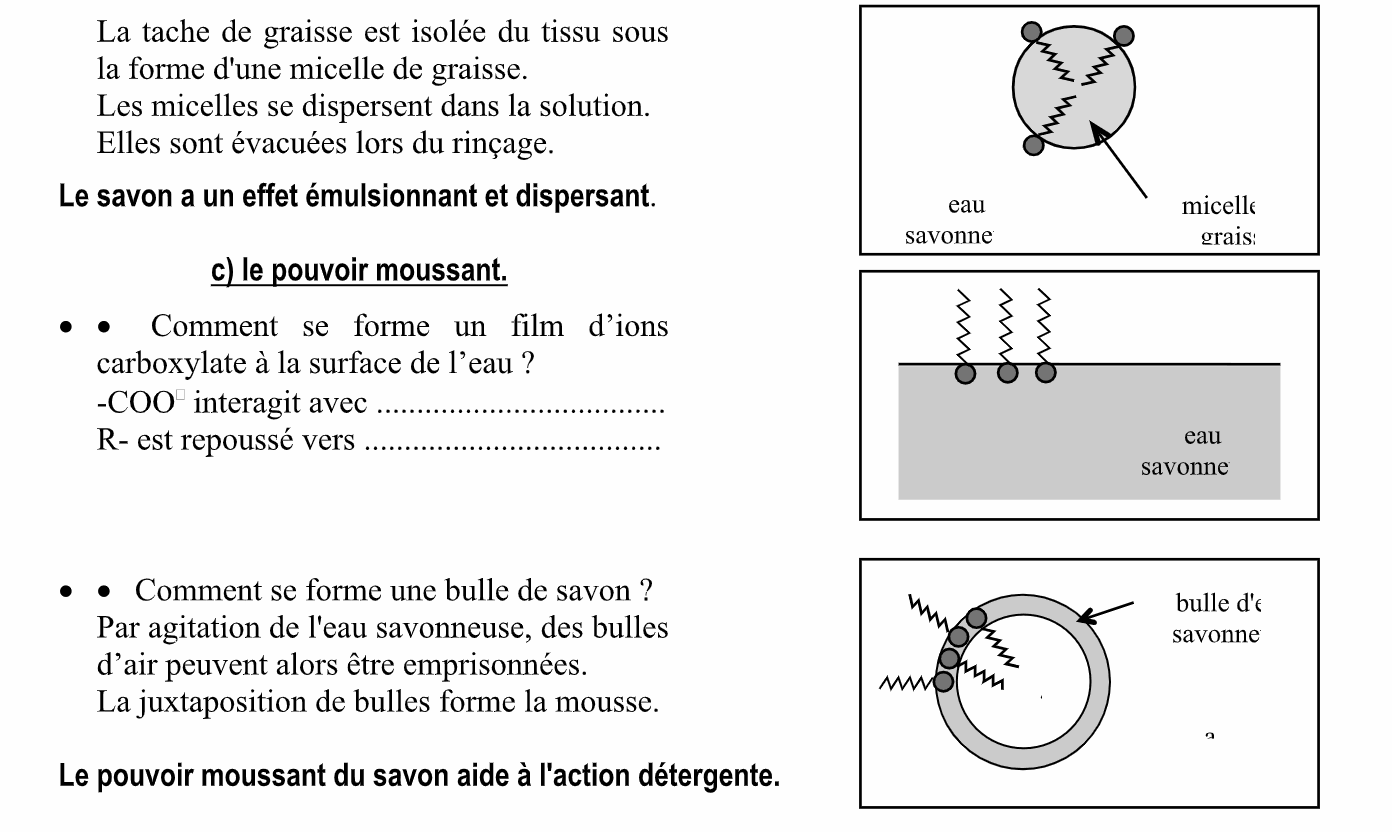
1. Caractère amphiphile de l’ion carboxylate.
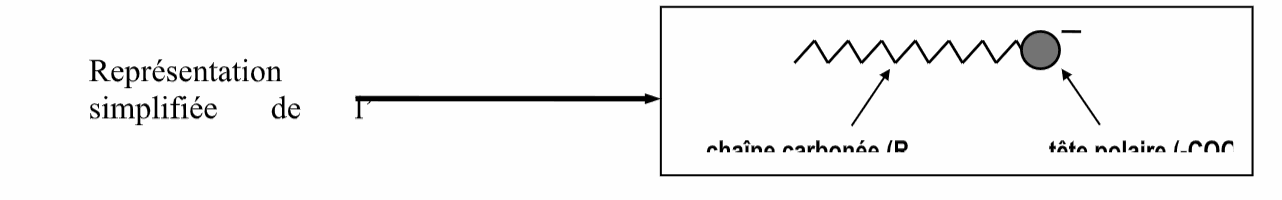
L'ion carboxylate présente une double affinité.
- La tête polaire s’entoure de molécules d’eau : elle est ............................................. (hudor : eau; philos : ami).
- La chaîne carbonée a une grande affinité pour d’autres chaînes carbonées (corps gras) : elle est ............................................ (lipos : graisse).
La chaîne carbonée n'a pas d'affinité avec l’eau : elle est ........................................ (phobos : peur).
L'ion carboxylate a des propriétés amphiphiles : c'est un agent tensioactif.
2. Comment agit un agent tensioactif ?
a) le pouvoir mouillant.


Explications supplémentaires
- le pouvoir mouillant d'un produit c'est sa capacité à permettre à l'eau de pénétrer entre les fibres textiles et à s'étaler sur une surface
Informations : On demande aux lessives actuelles des propriétés détergentes améliorées.
Elles doivent agir en eau dure. En fixant les ions Ca 2+ , les ions poly-phosphates ajoutés aux lessives ont un effet "anti-calcaire" et un rôle "anti-redéposition" des salissures. Mais ils sont corrosifs pour les lave-linge et polluants pour l'eau (eutrophisation).
Elles doivent également agir à basse température, détacher efficacement les protéines biologiques (œuf, sang, ...), avoir un effet blanchissant, redonner les couleurs au linge, ...
Tous les additifs incorporés ne sont pas sans inconvénients pour l'environnement. Il convient donc de respecter les doses d'utilisation.

Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.