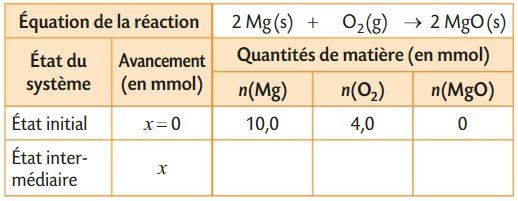
Tableau d'avancement
Ajouter à mes favoris
Réactifs, Produits et Restes
Le tableau d'avancement
Avancement d'une réaction chimique
L’avancement d’une réaction, noté x, est une grandeur exprimée en mole qui permet de décrire l’évolution des quantités de matière présentes dans un système au cours d’une transformation chimique.
Tableau d'avancement
Le tableau d’avancement décrit l’évolution des quantités de matière d’un système chimique de l’état initial à l’état final, en fonction de l’avancement x de la réaction.
Le système chimique évolue depuis l’état initial pour lequel x = 0 vers l’état final pour lequel x = xf. Les quantités des réactifs diminuent alors que celles des produits augmentent. Elles n’évoluent plus lorsque l’état final est atteint.
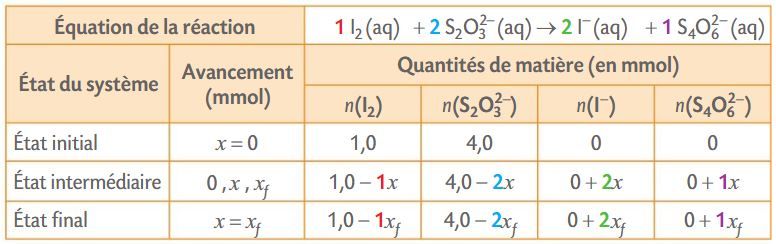
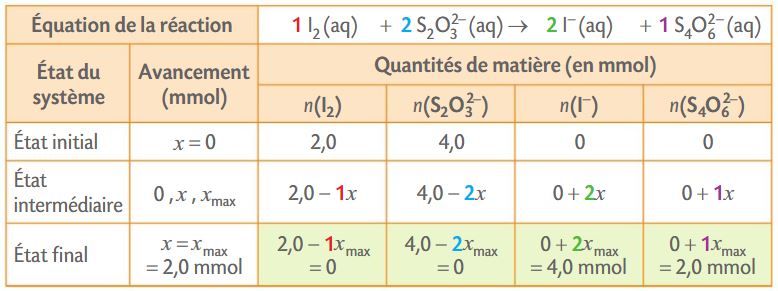
Exemple : Tableau d’avancement avec les quantités initiales des réactifs n0(I2) = 1,0 mmol et n0(S2O3²⁻) = 4,0 mmol.
Activité
Construire un tableau d'avancement
À haute température, 6,3 mmol de poudre de fer Fe(s) réagissent avec 4,6 mmol de dioxygène O2 (g). L’équation de la réaction s'écrit :3 Fe(s) + 2 O2 (g) -> Fe3O4 (s).
Construire le tableau d’avancement associé à cette réaction.
Utiliser un tableau d'avancement
Recopier puis compléter le tableau d’avancement.
Les transformations totales et non totales
L’avancement maximal xmax correspond à la plus petite valeur de l’avancement pour laquelle la quantité finale de l’un au moins des réactifs est nulle. Ce réactif est appelé réactif limitant.
Exemple : Recherche de la valeur de l’avancement maximal de la réaction entre le diiode I2 et les ions thiosulfate S2O3²⁻.
Hypothèse 1 : si I2 était le réactif limitant, alors 1,0 - 1xmax = 0 ; l’avancement maximal serait xmax = 1,0 mmol.
Hypothèse 2 : si S2O3²⁻ était le réactif limitant, alors 4,0 - 2xmax = 0 ; l’avancement maximal serait xmax = 2,0 mmol.
La plus petite des deux valeurs est la valeur de l’avancement maximal : xmax = 1,0 mmol. Le réactif limitant est le diiode.
Si xf = xmax, alors la transformation est totale.
Si xf < xmax, alors la transformation est non totale.
L’avancement final xy permet de réaliser le bilan de matière, c’est-à-dire de calculer les quantités de matière de toutes les espèces à l’état final.
Exemple : Quantités de matière à l’état final pour la réaction entre le diiode I2 et les ions thiosulfate S2O3²⁻, cette réaction étant totale :
nf (I2) = 0 mmol ;
nf (S2O3²⁻) = 4,0 – 2xmax = 2,0 mmol ;
nf (I⁻) = 2xmax = 2,0 mmol ;
nf (S4O6²⁻) = 1xmax = 1,0 mmol.
Pour une transformation non totale, il faut connaître la valeur de l’avancement final xf pour effectuer le bilan de matière à l’état final.
Activité
Exploiter la couleur d’un mélange réactionnel
Une solution violette de permanganate de potassium, K⁺ (aq) +MnO4⁻(aq), est versée dans une solution incolore contenant des ions fer (II) Fe²⁺(aq). La transformation est totale. La seule espèce colorée du système est l’ion permanganate, MnO4⁻(aq). À l’état final, la solution est incolore.
Justifier que l’ion MnO4⁻(aq) est le réactif limitant.
La quantité finale de l’ion MnO4⁻(aq), exprimée en mmol, est 5,0 x 10⁻² - xmax. Déterminer la valeur de l’avancement maximal xmax.

Déterminer l’état d’un système chimique
L’hydroxyde de fer (III) Fe(OH)3(s) est un solide orange obtenu à partir de la réaction d’équation :Fe³⁺(aq) + 3 HO⁻ (aq) -> Fe(OH)3 (s)
Initialement, le système chimique contient 3,0 mmol d’ions fer (III) Fe³⁺(aq) et 12,0 mmol d’ions hydroxyde HO⁻(aq).
Déterminer l’état du système chimique pour les avancements x = 1,0 mmol et x = 2,0 mmol.
L’avancement final du système est xf = 3,0 mmol.La transformation est-elle totale ?
Le mélange stoechiométrique
Soit la réaction d’équation :
aA +bB ->cC +dD
Un mélange initial est dit stœchiométrique si les quantités initiales des réactifs sont dans les mêmes proportions que les nombres stœchiométriques de l’équation de la réaction :
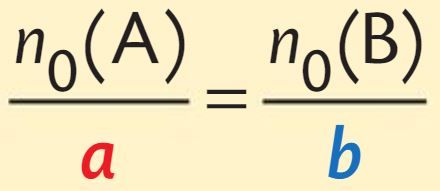
Dans le cas d’une transformation totale et pour un mélange stœchiométrique, les quantités finales des réactifs sont nulles. Seuls les produits de la réaction et éventuellement les espèces spectatrices sont présents à l’état final.
Composition de l’état final du système pour n0(I2) = 2,0 mmol et n0(S2O3²⁻) = 4,0 mmol.
Activité
Identifier des mélanges stœchiométriques
Le dihydrogène H2(g) peut réagir avec le dioxygène O2 (g) pour former de la vapeur d’eau H2O(g) selon la réaction d’équation :
Parmi les mélanges suivants, lesquels vérifient les proportions stœchiométriques ?
4 moles de H2 et 2 moles de O2.
4 moles de H2 et 4 moles de O2.
Exercices
Arbre de Diane
Dans un tube à essai, on verse un volume V = 5,0 mL de solution de nitrate d’argent, Ag⁺(aq) + NO3⁻(aq), de concentration molaire en ions argent C = 0,20 mol·L⁻¹. On immerge partiellement un fil de cuivre. La masse de la partie immergée est égale à m(Cu) = 0,52 g. Le fil de cuivre se recouvre progressivement d’un dépôt gris d’argent métallique, appelé arbre de Diane, et la solution bleuit. L’équation de la réaction s'écrit : 2 Ag⁺ (aq) + Cu (s) -> 2 Ag(s) + Cu²⁺ (aq)
M(Cu) = 63,5 g·moL⁻¹.
Établir le tableau d’avancement de la réaction.
Identifier le réactif limitant sachant que la transformation est totale.
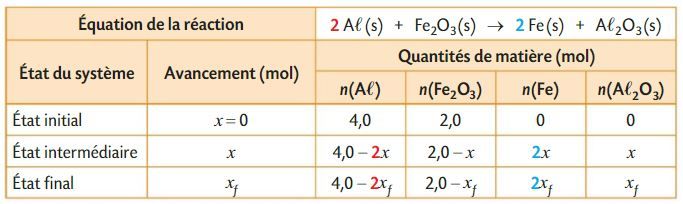
Aluminothermie
On considère le tableau d’avancement suivant :
Déterminer quantitativement l’état final du système chimique étudié sachant que la transformation est totale.
Identifier des relations de stoechiométrie
Le phosphate de calcium, Ca3(PO4)2(s), est obtenu selon la réaction d’équation :
3 Ca2+(aq) + 2 PO43-(aq) → Ca3(PO4)2(s)
Parmi les relations suivantes, identifier celles qui correspondent à un mélange stoechiométrique :
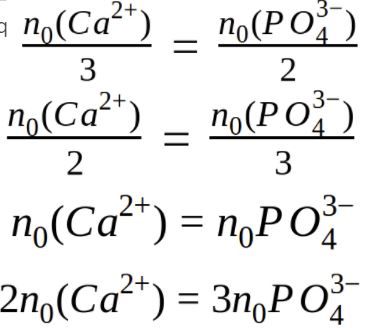
Pour aller plus loin
Sur (5 pts)
Des spéléologues explorent une cavité souterraine avec une bougie constituée de 0,500 mol d’acide stéarique de formule brute C18H36O2. La combustion de la bougie, c’est à dire sa réaction chimique avec le dioxygène de l’air, forme du dioxyde de carbone et de l’eau.
1) Déterminer la masse d’acide stéarique de la bougie.
2) Ecrire l’équation de la combustion de l’acide stéarique de la bougie.
3) La bougie se consume totalement : quel est le réactif limitant ?
4) Déterminer la quantité de matière minimale de dioxygène nécessaire à la consommation totale des 0,500 mol d’acide stéarique.
Données : masses molaires atomiques en g.mol-1 : M(C) = 12,0 ; M(H) = 1,0 ; M(O) = 16,0.
Sur (7 pts)
On mélange un volume V1 = 20 mL de solution de peroxodisulfate de sodium (2Na+ (aq)+S2O8 2- (aq)) de concentration molaire en ion peroxodisulfate C1 = 5,0x10-2 mol.L-1 et un volume V2 = 20 mL de solution d’iodure de potassium (K+ (aq)+I- (aq)) de concentration molaire en ion iodure C2 = 5,0x10-2 mol.L-1 . Une coloration brune apparaît progressivement.
1) Que peut-on conclure quant à l’apparition de la coloration brune ? Que peut-on déduire du fait qu’elle soit progressive ? L’équation de la réaction associée à la transformation chimique est : S2O8 2- (aq) + 2 I - (aq) 2 SO4 2- (aq) + I2(aq).
2)
a) En vous basant sur l’ensemble des données de l’énoncé, iindiquer les espèces chimiques spectatrices.
b) Qui est responsable de la coloration brune ?
3) Déterminer les quantités de matière des réactifs et des produits à l’état initial.
4)
a) Dresser le tableau d’avancement.
b) Déterminer l’avancement maximal xmax de la réaction et déterminer le réactif limitant.
c) En déduire les quantités de matière des réactifs et des produits à l’état final.
5) Déterminer la concentration molaire Cf(I2) du diiode à l’état final.

Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.